
作为人体免疫系统的“特种兵”,T细胞可以清除病原体和肿瘤细胞。近年来,基于T细胞免疫发展的PD-1阻断疗法(2018年诺贝尔奖)和CAR-T细胞免疫疗法(2024年科学突破奖)在癌症治疗上取得重大突破,但其临床应用仍然有限,亟待更多基础研究的突破。
T细胞免疫的触发机制究竟是什么?对于这一重大科学问题,中国科学院分子细胞科学卓越创新中心研究员许琛琦领衔团队,以关键免疫受体为主线做了系列研究,为发展新一代免疫治疗手段提供重要理论基础。
6月24日,该研究成果获国家自然科学奖二等奖。
【入选2016年度中国科学十大进展】
T细胞在执行抗肿瘤抗感染任务时,依赖的是它表面的感知蛋白,也就是免疫受体。
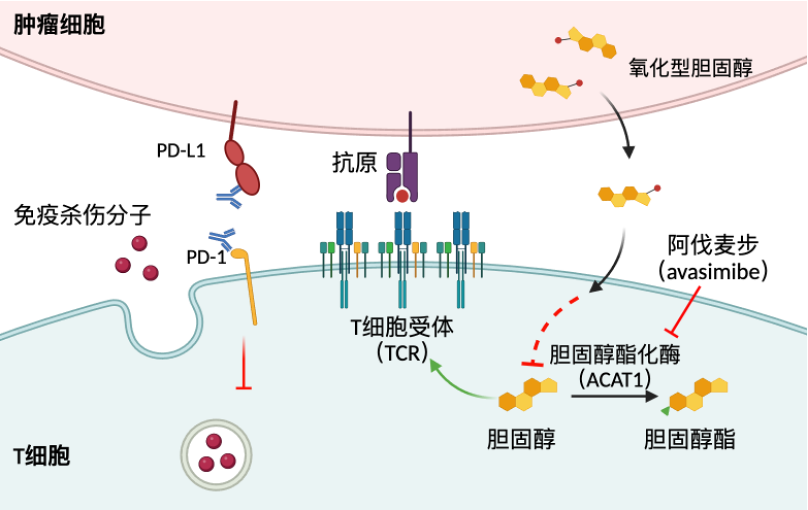
TCR是负责识别抗原的主要受体,它会发出抗原刺激信号。除了正向调控信号,也有负向调控信号,以PD-1为代表的共抑制信号,主要是限制细胞过度活化。这些受体的功能受周围脂质分子的直接调控。在各种疾病场景,尤其在肿瘤微环境里,这些受体的功能都会发生动态变化,导致T细胞失去“战斗力”。
研究团队观察到了TCR触发的四种状态:静息态、活化态、放大态和衰减态,发现了近膜静电调控元件在受体触发中的关键功能,提出了“近膜静电调控”学说,并进一步验证了该理论对其它膜蛋白的普适性。这一创新理论被国内外同行广泛论证。
T细胞活化后,其细胞内的胆固醇代谢会重新编程,产生大量胆固醇来帮助TCR信号,同时支持细胞增殖。但是肿瘤细胞会分泌一种代谢物来抑制T细胞的胆固醇水平。团队研究发现,如果抑制胆固醇的“搬运工”——ACAT1(胆固醇酯化酶),就可以释放更多的胆固醇来支持“特种兵”的杀敌功能。研究团队利用ACAT1的小分子抑制剂在小鼠模型中治疗肿瘤,发现具有很好的抗肿瘤效应。此项研究入选2016年度“中国科学十大进展”。
【正在长征医院进行临床试验】
T细胞依靠TCR识别肿瘤,但并非体内所有的TCR都能识别肿瘤,因此人们为T细胞装上特异性识别肿瘤抗原的嵌合型抗原受体(CAR),可精准“击杀”肿瘤,简称CAR T细胞。
不过,CAR T细胞治疗也有明显缺点——对血液瘤的治疗容易复发;对实体瘤的治疗效果差;CAR T细胞过度“活跃”容易引起细胞因子风暴,引发危险。此外,CAR T技术如何应用于其他疾病的治疗也有待进一步的研究。
“TCR经历了从鱼到人的进化,是CAR T技术的源头。我很好奇,能否利用进化的力量指导CAR的设计。”许琛琦告诉解放日报·上观新闻记者。
利用“近膜静电调控”理论,团队发现TCR中的关键信号分子CD3ε,既能放大信号,又能限制信号过度活化,相当于自带“油门”和“刹车”。他们把CD3ε加到现有的CAR中去,形成一种新的E-CAR技术。好比在一辆铲车中配置了新型发动机,不仅续航更久(细胞生长持续性更好),而且排放更低(细胞因子分泌更少),从而减少细胞因子风暴,具有更强的清除靶细胞活性,该技术可以用于肿瘤和自身免疫病的治疗。目前,该成果已转化,正在长征医院进行临床试验。
此外,研究团队还发现了PD-1分子的降解机制,正在针对这个新靶点开发免疫治疗策略。
【“这里的创新文化和宽松环境,在国内不多见”】
2009年在哈佛大学医学院完成博士后工作,许琛琦选择回到中国科学院分子细胞科学卓越创新中心,就一直埋头于T细胞的功能调控研究,也持续不断地产出成果。
“这里的创新文化和宽松环境,在国内不多见。”许琛琦告诉解放日报·上观新闻记者,所里的科研经费、实验室空间和研究生名额都与人才帽子相脱钩,“即使评上院士后,从所里获得科研经费,也是按照科研成果来分配。这对于青年学者来说是一种鼓励。”
值得一提的是,只要有研究人员去做项目申请答辩,所里都会组织模拟预答辩,竞争力一下就提高许多。
前段时间,许琛琦和所里几位课题组长自发组成了“淋巴细胞赋能攻关团队”,每周会进行一次学术讨论。所里向来鼓励自由探索,给予了稳定的经费支持。淋巴细胞是机体免疫应答功能的重要成分,可分为T细胞、B细胞和自然杀伤(NK)细胞。“现在是免疫治疗时代,免疫细胞的研究大有可为。”许琛琦说。
原载于解放日报·上观新闻 2024-06-24
作者:黄海华