
1994年被批准为博导,1993年特聘为研究员,1989年被破格晋升为副研究员,1983年在中科院原上海生化所研究生毕业并获硕士学位,1979年毕业于北京大学生物系生化专业。曾在美国Dartmouth医学院先1年、后多次短期合作研究(Visiting Scientist,1993-1994、1998、2000、2002)和美国New Jersey-UMDNJ从事研究2年(Research Associate, 1986-1988)。
2000年至今在中科院上海生科院生化与细胞所、现为中科院上海生化与细胞所从事研究,首任所长(2000-2003)、研究组长、博导、研究员、学位委员(2000-2014)和学术委员。曾在中科院原上海生化所从事研究(1983-2000),任所长(1997-2000)、常务副所长(1995-1997,法人代表主持工作)、学术委员会主任(1995-2000)、研究组长(1991-2000)、博导(1994-2000)、研究员(1993-2000)、学术委员(1992-2000)、学位委员(1992-2000)、副研究员(1989-1993)。
兼任:国家基金委生命科学部第七-六届咨询委员会委员(2014-2020),国家基金委2个重大研究计划专家组(细胞器专家组成员2017-2025、RNA专家组副组长2014-2022),中国生化与分子生物学会脂蛋白专业委员会的副主任(2009-)、常务委员(2006-),Acta Biochim Biophys Sin,主编(2006-)、副主编(2002-2006)、常务编委(1996-),《中国生物化学与分子生物学报》副主编(2011-)、常务编委(2011-)、编委(2004-2010),《生命的化学》副主编(2002-)、常务编委(2002-)、编委(1998-2002)。曾兼任:中国生化与分子生物学会基因专业委员会主任(2005-2015),中国生化与分子生物学会第10届常务理事(2009-2014)、第8届副理事长兼秘书长(2001-2005)、第7届副理事长(1997-2001),上海市生化与分子生物学会连续3届理事(1992-2003),中国生物工程学会第4届理事(2005-2009)、第3届常务理事(2001-2005)、第2届理事(1997-2001),上海市生物工程学会第3届常务理事(2002-2006)、第2届理事(1999-2002),中科院生命科学/微观生物学(1997-2003)、生物技术(1996-2003)和国际合作(1996-2003)的3个专家委员会委员,《Cell Research》编委(2002-2006),《科学通报》特邀编委(2001-2008),中科院上海生科院的党委书记(2002-2004)和学术委员会常务委员(1999-2006),上海交通大学教授(1997-2000),1998年被聘中国医科院医学生物学研究所教授,1994年被聘浙江大学教授。
对科研工作的追求:尽兴选择、反复论证有基础积累的前沿性课题,即时创造、精细掌握项目课题研究所需要的技术方法,纵深拓宽、交叉运用所学知识于研究实验分析,细致观察、实验解决研究进程所遇关键性问题,及时调整、不断实验有针对性的研究思路,善于总结、科学表达大量实验所获得的数据结果,创建系统、多方协作以促进突破,严谨踏实、奋进提升科学研究素质及其智慧品位和社会责任。至今,主持或合作负责完成研究含国家基础研究重大计划项目(首席专家)、国家"863"高技术项目、国家"973"项目的课题、国家基金委重大项目的课题与面上项目、中国科学院重大项目和重要方向项目、上海市基础研究重大重点项目与生物医药重点项目等;发表研究论文110多篇、综述专著20多篇,其中在Nature、Nat Cell Biol、Cell Metab、Cell Res、J Mol Cell Biol、J Lipid Res、J Biol Chem、Acta Biochim Biophys Sin等学术期刊发表通讯或共同通讯作者研究论文60多篇;发明专利已授权13项、申请中10项;获2016年中国科学十大进展和中国生命科学领域十大进展、1990年中科院十大科技成果;获国家科技进步二等奖1项、中科院自然科学二等奖1项、中科院科技进步一二等奖各1项和三等奖2项、卫生部科技进步一等奖1项、江苏省科技进步三等奖1项、上海市科技进步二等奖1项;获1994年首届国家杰青、国家"863"和"七五"攻关研究突出贡献表彰、中科院突出贡献中青年科学家、上海市优秀专业技术人才、香港求是科技基金会杰出青年学者等;1994年获国务院政府特殊津贴。
对研究生、博士后及进修人员的寄语:一旦选择科研并踏上这条崎岖之路,就要能动地尽快适应这样的环境,从大量基本事情独立起步你的研究,不断实验、不断失败、不断学习、不断调整、不断重复、不断总结等等,无论如何要炼硬身心、要鼓足精力、要勇于开拓、要积极进取、要严谨踏实、要互助合作等等,直至实现勤悟巧进。至今,指导博士后5名,带博士生25名、硕士生28名(成为PI的10名,获中国科学院院长特别奖2名、获中国科学院院长优秀奖2名、获中国科学院地奥奖3名、获研究所所长奖11人次);获得1999年中科院优秀博士生导师奖、1997年中科院上海分院优秀博士生导师奖。
实验室一直从事生化、分子生物学等方面工作,研究方向先为基因的表达功能、后聚焦于固醇代谢平衡?生理病理调控?靶标系统创建,主要围绕胆固醇代谢关键酶表达功能和固醇转运调控,长期与美国Dartmouth医学院TY Chang教授合作,着重研究细胞胆固醇代谢平衡关键酶--酰基辅酶A:胆固醇酰基转移酶(ACAT)的表达功能,探索ACAT的基因结构、转录剪接、翻译修饰、表达调控、功能模式及其与胆固醇代谢平衡的生理功能、病理变化等关系,包括与细胞质膜游离胆固醇的动态平衡、细胞胆固醇及其代谢物固醇的载运特异脂蛋白分泌外排和转运调控、动脉粥样硬化(AS)病(如冠心病、中风)、神经退行性疾病(如老年痴呆症,AD)、癌症(如肝癌,HCC)等关系,深入ACAT靶标系统创建及新药研发等,取得了系统性前沿原创成果。
ACAT是细胞内唯一催化游离胆固醇与长链脂肪酸生成胆固醇酯的酶,是胆固醇代谢平衡的关键酶,对细胞生命、细胞命运与细胞活动发挥极重要的功能作用。ACAT家族有ACAT1和ACAT2,ACAT1在人体所有组织细胞中表达,而ACAT2具有细胞、发育、种族特异性高/低水平表达。
一、ACAT表达功能及固醇转运调控
在前期研究基础上,加强与相关基础领域、医药临床等方面的合作研究,涉及主要内容为ACAT1基因表达的新型反式剪接及其与胆固醇代谢平衡等关系、ACAT2肝肠细胞特异表达及其与肝癌的关系、ACAT1/2单核-巨噬细胞表达协同效应、ACAT表达与细胞质膜胆固醇动态平衡及其对细胞生命/细胞命运/细胞活动的影响、ACAT表达功能相关的网络调控等,旨在构建前沿研究体系、不断揭示ACAT表达与功能机制、发现胆固醇代谢关联的生理功能与病变机理。
Fig. 1 简要总结我们研究人ACAT1进展的概况与重点,已在国际有影响力学术期刊上发表通讯或共同通讯作者研究论文10多篇,发明专利获授权的5项、申请中的8项。主要工作是:发现ACAT1调控免疫杀伤 T 细胞的抗肿瘤活性和创建基于胆固醇代谢的抗肿瘤新方法(Nature, 2016),该工作被评为2016年中国科学十大进展、中国生命科学领域十大进展;发现ACAT1引起APP-alpha加工变化,提出ACAT1调控细胞质膜游离胆固醇动态模型(ABBS, 2015);发现ACAT1 56-kD蛋白来源于内-外源性反式剪接的mRNA翻译,提出相应的内-外源性反式剪接模型(Cell Res, 2013),对生命体的共生学说具有重要意义和补充该反式剪接模型进教科书;发现miR-9降低THP-1来源巨噬细胞的ACAT1活性和抑制泡沫细胞形成(ABBS, 2013);发现TNF-alpha可直接上调分化中单核细胞的ACAT1表达而促进泡沫细胞形成(JLR,2009);揭示人ACAT1 mRNA 的5'非翻译区通过促进其mRNA快速降解影响蛋白翻译产生(ABBS, 2009);揭示人ACAT1 56-kD蛋白产生需要其mRNA 跨染色体区域的RNA茎环结构(Cell Res, 2008);发现来自两条染色体、反式剪接成熟的人ACAT1 mRNA翻译一种56-kD异构体酶(JBC, 2004);发现糖皮质激素地塞米松(Dex)促进泡沫细胞形成,揭示Dex增强人ACAT1基因表达的分子机制 (Cell Res, 2004);发现人ACAT1 mRNA 5'-ORF-AUG上游稳定茎环结构具有增强选择下游起始密码子翻译的功能作用(ABBS, 2004);揭示干扰素-gamma与ATRA作用人单核细胞而协同调控人ACAT1基因P1启动子的转录活性(JBC, 2001)。
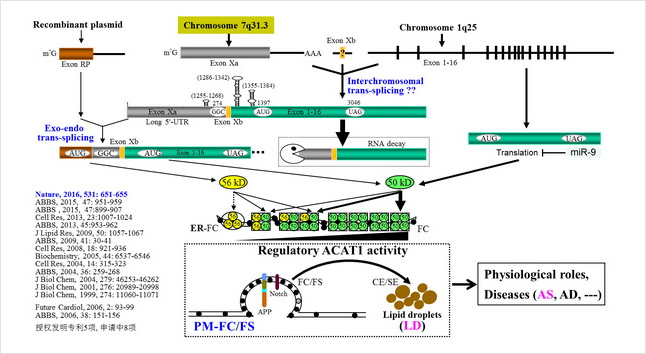
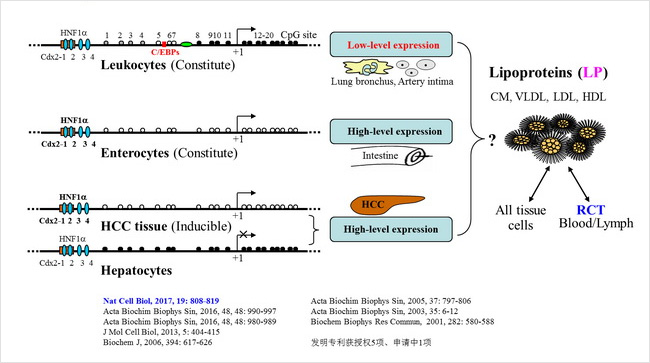
Fig. 2 简要总结我们研究人ACAT2进展的概况与重点,已在国际有影响力学术期刊上发表通讯或共同通讯作者研究论文近10篇,发明专利获授权的5项、申请中的1项。主要工作是:发现ACAT2的Cys277泛素化修饰-氧化竞争机制和胆固醇、脂肪酸调控ACAT2蛋白稳定及其抗糖尿病作用(Nat Cell Biol, 2017),紧密关联能量代谢ROS效应;发现人白细胞低水平表达ACAT2与特异脂蛋白分泌外排(ABBS, 2016b);发现转录因子C/EBP调控单核类细胞ACAT2低水平表达(ABBS, 2016a);发现肝癌诱导高水平表达ACAT2消除肝外全身来源累积的极毒性胆固醇代谢物(J Mol Cell Biol, 2013),用于创新研发治疗肝癌的特效药;揭示转录因子Cdx2、HNF-1alpha协同调控ACAT2基因的细胞特异和肠细胞分化依赖性表达机制,发现肝癌组织异常高表达ACAT2而可成为特异性诊断标记分子(Biochem J, 2006);发现人ACAT2基因表达的可变性剪接成熟mRNAs及其翻译产生具有不同酶活性异构体(ABBS, 2005);揭示人ACAT2基因的组织结构和启动子序列,发现人ACAT2基因启动子具有细胞特异和肠细胞分化依赖的转录活性(BBRC, 2001)。
二、ACAT靶标系统创建及新药研发
在ACAT前沿研究的积累基础上深入探索与HCC、AD、AS等紧密关联的靶标系统,包括针对调控人Acat1/2表达的特异性顺式元件(SGNE、ABE、HCE等)创建用于规模性筛选小分子化合物系统、创建细胞ACAT1/2活性直接测定的技术方法系统、创建规模性检测高选择性人ACAT抑制剂活性分析的细胞模型系统等。
Fig. 3简要总结人ACAT1/2的主要细胞水平功能与相应靶标系统。在ACAT靶标系统创建及新药研发中,已合作研发高选择性ACAT2的特异抑制剂 (Org Biomol Chem, 2016)并在申请国内外发明专利;已创建可规模性测定组织细胞水平分泌外排LP的ACAT2酶活性及其用于筛选具有抑制的活性小分子化合物等技术方法体系;在深入创建相近于人胆固醇代谢小鼠等模型动物中。这些为相关新药研发等奠定厚实基础。

我们实验室在已有的系统性前沿研究积累基础上,针对ACAT的底物具有3-beta羟基的游离固醇(FS)和产物固醇酯(SE),结合LC-MS/MS等仪器分析,试创建准确测定细胞质膜游离固醇(PM-FS)、白细胞分泌外排的特异性脂蛋白eLDL及其载运的固醇组分等技术方法体系,确保深入研究ACAT表达功能的同时、进一步拓展探索ACAT对PM-FS和转运固醇脂蛋白(LP)的动态平衡调控、特别兴趣构建白细胞ACAT1/2协调活性的靶标系统创建等,旨在完善更完整的前沿研究体系,不断揭示ACAT的表达功能机制、发现固醇代谢关联的生理功能、病变机理,形成更有特色系统工作,为相关的HCC、AD、AS等疾病的预防、诊治、药物研究提供理论依据和重要基础,促进转化应用与人类健康。

合影