
2004年7月获华东师范大学学士学位;2010年7月获中国科学院上海生科院博士学位,之后留所工作一年;2011年10月至2016年7月在美国西南医学中心Sean J. Morrison实验室从事博士后研究,期间获Leukemia & Lymphoma Society Fellowship资助;2016年8月入职中国科学院生化与细胞所(现名:分子细胞科学卓越创新中心),任研究员,研究组长,博士生导师。2018年获中国干细胞协会青年研究员奖。2022年获上海市优秀学术带头人(青年)。
本研究组以小鼠为主要研究模型,以骨髓为主要研究器官,以谱系示踪(Lineage-tracing)、条件性基因剔除(Conditional gene knockout)和单细胞组学(Single-cell -omics)为主要研究手段,探索成体干细胞和肿瘤干细胞的异质性及其赖以生存的微环境(巢,niche)。目前的研究内容包括:
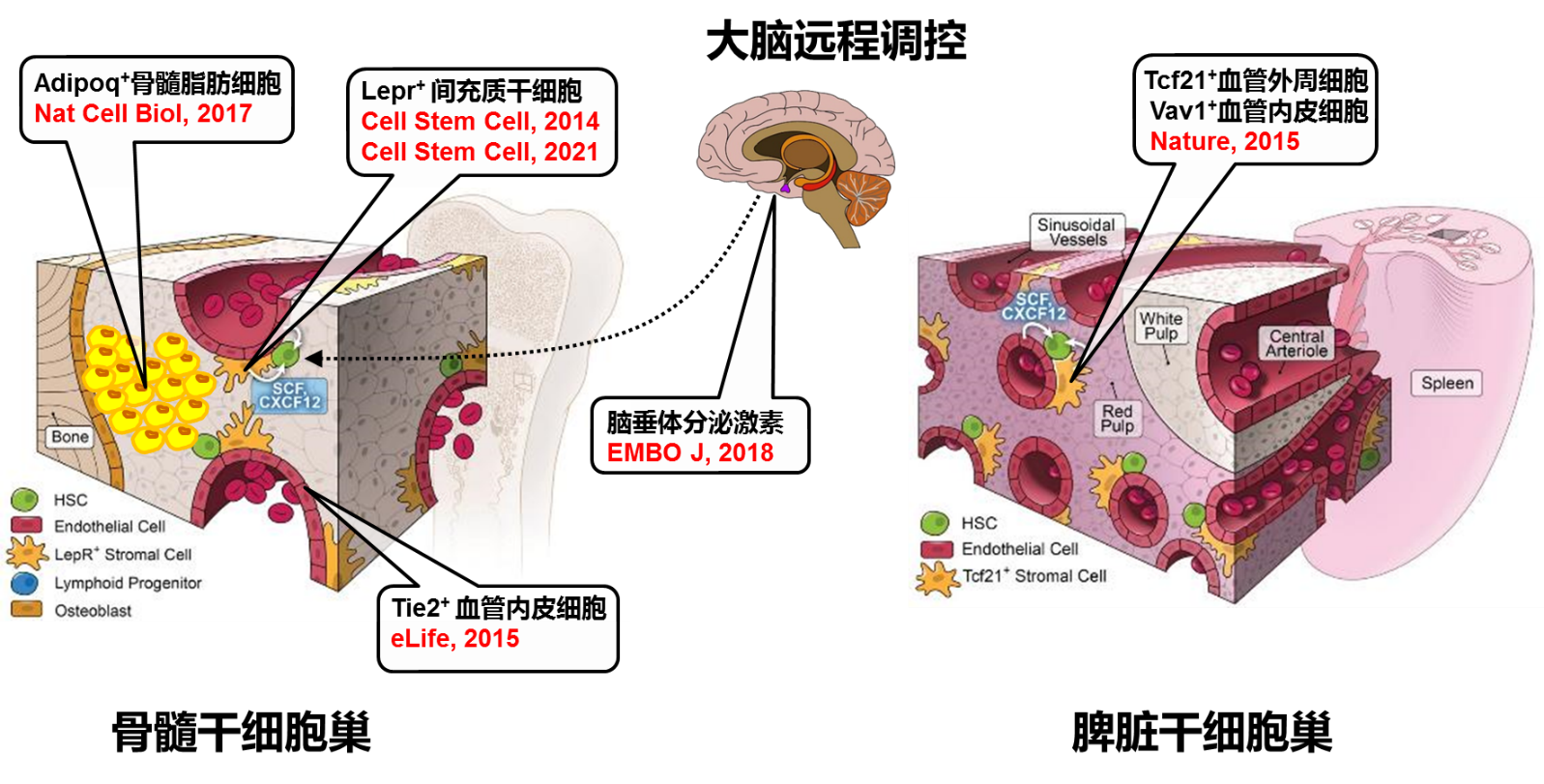
1. 造血干细胞巢的体外重建与人造血液
造血干细胞(Hematopoietic stem cell,HSC)是一类具有自我更新能力的,在发育过程中及应激条件下能够分化成包括红系(Erythroid)、髓系(Myeloid)和淋巴系(Lymphoid)在内所有血液细胞的始祖细胞。在生理条件下,造血干细胞主要存在于骨髓中特异性的干细胞巢(niche)内。干细胞巢通过分泌生长因子促进造血干细胞自我更新(附图)。
造血干细胞是临床应用最广泛的成体干细胞。造血干细胞移植的适应症包括:①血液系统肿瘤性疾病:白血病、淋巴瘤、多发性骨髓瘤、骨髓增生异常综合征;②血液系统非肿瘤性疾病:重症再生障碍性贫血、Fanconi贫血、骨髓纤维化;③实体瘤:小细胞肺癌、乳腺癌、卵巢癌、睾丸癌、神经母细胞瘤、复发性骨肉瘤、颅脑肿瘤等;④其它:严重自身免疫性疾病、免疫缺陷病、骨硬化病和某些代谢产物蓄积病等。
尽管造血干细胞的移植技术已经成熟,造血干细胞的来源短缺一直是相关疾病治疗的最大瓶颈。目前我国等待造血干细胞移植的患者有100多万,仅白血病患者每年新增4万人以上,其中大部分是青少年和儿童。因此,阐明造血干细胞的自我更新机制并实现造血干细胞的体外扩增,是目前造血干细胞研究的核心问题。关于造血干细胞,本研究组有以下两个研究目标:
1) 探索生理以及病理条件下造血干细胞巢的组成与功能。
2) 利用体外重建的干细胞巢实现人造血液的规模化制备。
2. 白血病干细胞巢的组成鉴定与靶向治疗
与正常组织一样,肿瘤组织也存在一群始祖细胞,称为肿瘤干细胞。白血病干细胞(Leukemia stem cell)是经典的肿瘤干细胞,是一群具有自我更新能力、并能产生异质性白血病细胞群体的白血病细胞。白血病干细胞的存在可使肿瘤的手术和放化疗失败,导致手术后和放化疗后的肿瘤复发。经典的观点认为,白血病干细胞劫持了正常造血干细胞的自我更新机器。针对白血病干细胞,本研究组有以下两个研究目标:
1) 阐明白血病细胞对正常造血干细胞巢功能的影响。
2) 通过干扰白血病干细胞巢实现白血病的靶向治疗。
3. 间充质干细胞与组织损伤修复
间充质干细胞(Mesenchymal stem cell)是广泛存在于各种成体组织中的基质前体细胞,是目前除造血干细胞以外最具医用价值的成体干细胞,被称为组织修复的“微药厂”,其临床试验已覆盖美容、抗衰老、抑制肿瘤和调节免疫等。骨髓中的间充质干细胞又称骨骼干细胞(Skeletal stem cell),其主要生物学功能是骨骼生成和再生,同时,它们也是造血干细胞巢的关键组分。针对间充质干细胞,本课题组有以下两个研究目标:
1) 探索骨髓间充质干细胞的异质性及其造血调控作用。
2) 探索非骨髓组织的间充质干细胞的生理及病理功能。
(2024年)
(2023年)
(2022年)
(2021年)
(2020年)
(2018年)
(2017年)
博后阶段:(2011年~2016年)
研究生阶段:2010年以前

合影