2014年2月18日,国际学术期刊《The Journal of Biological Chemistry》在线发表了中国科学院上海生物化学与细胞生物学研究所/国家蛋白质科学中心·上海(筹)周兆才研究组的最新研究成果-“Striatins Contain a Noncanonical Coiled Coil That Binds PP2A A to Form a 2:2 Heterotetrameric Core of Striatin-interacting Phosphatase and Kinase (STRIPAK) Complex”。该成果从三维结构上揭示了STRIPAK复合物的装配特征。
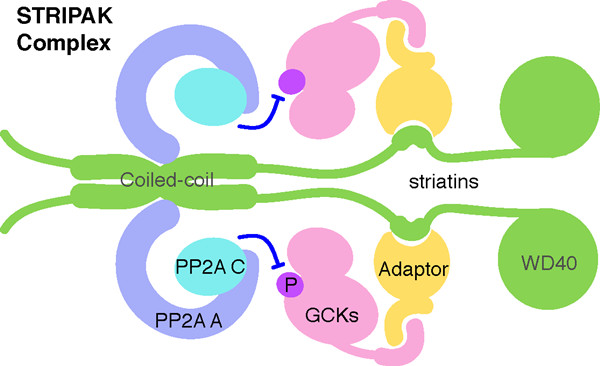
STRIPAK是新近鉴定出来的进化上保守的激酶-磷酸酶多组份复合物,在信号转导(如调控Hippo通路)、细胞周期、细胞凋亡、极性和迁移、囊泡运输、神经及血管发育等方面具有重要功能,与癌症、心脏病、糖尿病等重大疾病的病理过程密切相关。Striatin作为一类新的PP2A调节亚基,同时招募PP2A核心酶(包含PP2A A亚基和C亚基)和Germinal Center Kinase(GCK)家族激酶,从而形成STRIPAK复合物。目前已发现的STRIPAK复合物的激酶组份包括GCK成员:MST1/2、MST3、MST4、STK25,以及MINK等。其中,MST3、MST4,以及STK25通过CCM3/PDCD10连接到striatin,而MST1/2则可能通过RASSF或者SLMAP来间接地与striatin结合。
周兆才研究组近年来在GCK激酶方面开展了一系列研究:阐释了MST1/2 作为Hippo信号通路核心激酶的自身寡聚特征(J Struct Biol,2014),及下游信号转导与调控的新机制(Cancer Cell和Cell Res,2014);揭示了MST4作为肿瘤抑制因子LKB1下游激酶被MO25调控激活,及其与PDCD10形成异源复合物调控细胞生长和迁移的结构机制(Structure,2013,2篇)。在此基础上又对GCK参与的STRIPAK复合物进行了研究,以期深入了解其结构、组装与功能机制。
在本项研究中,周兆才研究组的陈翠翠,史竹兵和焦石等人通过晶体结构分析,并运用生物化学与细胞生物学等方法对striatin与PP2A A亚基核心复合物的相互作用进行了阐释。发现striatin的coiled coil结构域形成非经典的不对称的平行二聚体。在此二聚体中,一条螺旋链是近乎平直的,而另一条的中间区域则出现大幅度的弯折,致使螺旋中断。基于三维结构的突变研究发现striatin同源二聚之后招募PP2A A亚基到其同源二聚体界面两侧,从而形成2:2的异源四聚体。经典的PP2A全酶是由A、B、C亚基形成的1:1:1的异源三聚体,而striatin介导的PP2A全酶则为2:2:2的异源六聚体,代表着一种新型PP2A全酶的装配方式。进一步的功能研究表明:野生型striatin能招募PP2A核心酶来负调控MST3的激酶活性,进而抑制MST3诱导的细胞凋亡;而打破二聚化的突变体则无此效应。这项研究揭示了STRIPAK复合物的组装特征,为进一步研究其功能与机制奠定了结构基础。
该项工作得到科技部、国家自然科学基金委、上海市科委以及中科院的经费资助。