姜海研究组等合作研发新型高效DNA/HDAC双靶点抗癌药物
来源:
时间:2015-05-13
2015年3月10日,国际学术期刊EMBO MOLECULAR MEDICINE在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所姜海研究组等合作研究的最新成果"A DNA/HDAC dual-targeting drug with significantly enhanced anticancer potency",该成果成功研发了一个DNA/HDAC双靶点的新型药物,并通过对该药物的研究,揭示发展类似的新型高效双靶点抗癌药物的可行性。
DNA损伤药物是临床应用最为广泛的癌症化疗药物,通过对细胞的DNA损伤,造成细胞内的DNA双链断裂,实现对癌细胞的杀伤。然而,细胞内存在多种DNA损伤修复途径,可以减轻药物对癌细胞的损伤,从而使部分癌细胞得以存活,导致治疗失败。例如,氮芥类药物是非常重要的一类DNA损伤抗癌药物,而细胞内的一些DNA损伤修复途径,例如FA、TLS和HR通路等,可以修复氮芥类药物在癌细胞中造成的DNA损伤,从而极大地限制了该类药物的治疗效果。苯达莫司汀(Bendamustine)是一个广受关注的氮芥类药物,近期被批准用于CLL、SLL、FL、MCL等淋巴瘤及白血病的临床治疗,但其杀伤力仍然不够强,需要进一步的优化和创新研究。
在姜海研究员的指导下,博士研究生刘传、丁宏宇、李晓曦等人与美国Crystal LLC公司合作,对合成的一系列Bendamustine的衍生物进行筛选,发现了一个候选分子——CY190602,相比于Bendamustine,CY190602对癌细胞的杀伤能力有50到100倍的显著提高。通过实验室特有的功能遗传学筛选系统,证明了CY190602除去原有的DNA损伤功能,还在药物侧链上额外获得了组蛋白去乙酰化酶(histone deacetylase,HDAC)的抑制活性。有趣地是,通过对ATR-Chk1、FA、TLS和HR通路的筛查,研究人员发现,几个参与DNA修复的重要基因如Tip60、CBP、MORF和MSL1,在HDAC酶被抑制后,表达量显著下降,从而减低了细胞对DNA损伤的修复能力。这表明,CY190602同时具有攻击癌细胞DNA和抑制癌细胞DNA修复的能力,从而解释了这个药物高效抗癌活性的来源。在一系列的小鼠肿瘤模型实验中,与多种传统化疗药物相比,CY190602的疗效都有明显提高,同时,该药物对正常组织如造血系统等的毒性更小。在BCR-ABL驱动的白血病小鼠模型中,CY190602也取得了与BCR-ABL靶向抑制剂相同的疗效,表明这个双靶点药物在体内具有高效抗癌能力。
该项研究发现了一个新型的DNA/HDAC双靶点药物CY190602,相比于传统的单靶点氮芥类药物,该药物额外获得的对HDAC酶的抑制能力使其能更有效地杀伤癌细胞。该项研究既是一项药物研发的成果,也同时指明了一条新的药物研发道路:通过在传统化疗药物上添加DNA修复酶的抑制基团,可以产生一类全新的高效抗癌药物,从而获得对癌症更加有效的治疗效果。在此理论的指导下,一系列新型药物如DNA/CDK1双靶点药物等已被合成,并表现了明显提高的抗癌能力。这些药物不仅自身就有很好的治疗效果,它们的高效杀伤癌细胞的特性也为未来的抗体交联药物、肿瘤靶向输送药物的研究提供新的候选方案。
该项研究工作是由姜海研究组与美国Crystal LLC公司合作完成,来自第二军医大学、麻省理工学院、浙江民生药业、美国 NIH和新墨西哥大学的研究人员也参与了该项研究。该项研究得到国家自然科学基金、上海市重大科学项目、中科院、长海医院和上海市科委的经费支持。
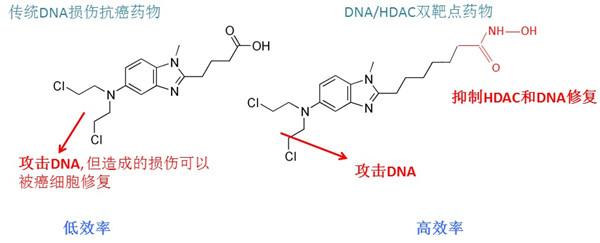
图:相比于传统DNA损伤药物,新发现的DNA/HDAC双靶点药物能同时攻击DNA并抑制DNA修复,从而显著提高对癌细胞的杀伤效果。
