近日,上海生科院生化细胞所国家蛋白质科学中心•上海(筹)(简称“中心”)特聘研究员兼清华大学教授饶子和(Zihe Rao)院士和中心张荣光(Rongguang Zhang)研究员领导研究团队,在新发MERS/SARS冠状病毒研究中取得了重要进展,首次揭示了nsp14–nsp10复合体的结构基础,阐明了冠状病毒编码校正的分子机制,该研究成果于7月9日在线发表于美国《国家科学院院刊》。
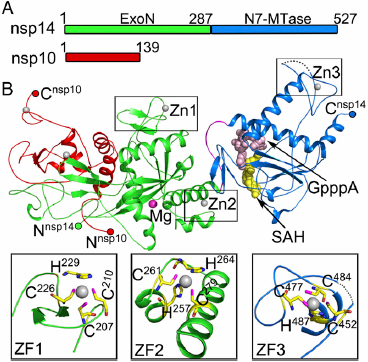
图1. Nsp10-nsp14复合物的结构
冠状病毒(CoV)是目前基因组最大的一种RNA病毒,能够感染人类引起多种急性和慢性疾病,其中最引人注目的就是SARS和最近困扰韩国的MERS。
冠状病毒的庞大基因组编码了结构蛋白、非结构蛋白和一些辅助蛋白。科学家们发现,冠状病毒的非结构蛋白14(nsp14)对于病毒的复制和转录很重要。该蛋白的N端具有核糖核酸外切酶(ExoN)结构域,该结构域的校读功能可以防止基因组出现致死性突变。而nsp14的C端结构域具有甲基转移酶活性(N7-MTase),负责对病毒mRNA进行加帽。不过,人们并不了解nsp14行使这些重要功能的分子基础。
非结构蛋白10(nsp10)是能够与nsp14结合的激活子。研究人员对SARS-CoV进行研究,获得了nsp14、nsp10以及功能性配体结合时的晶体结构。这是首次揭示与RNA病毒校读有关的nsp14–nsp10复合体结构。研究人员通过结构数据和功能分析,进一步阐明了nsp14的功能,还揭示了一些可以用于药物开发的重要靶点。
在该工作中,国家蛋白质科学研究(上海)设施五线六站高通量线站(BL17B)和复合物线站(BL19U)科技人员积极参与,在实验方面提供了强有力的专业技术支持,为成果的发表做出了积极贡献。
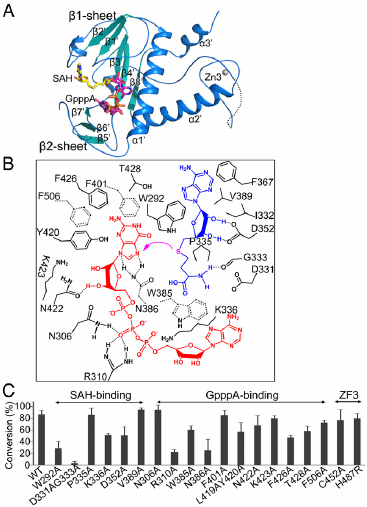
图2. nsp14 N7-MTase domain的结构与甲基转移机制