4月29日,知名国际学术期刊Nucleic Acids Research在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所国家蛋白质科学中心(上海)雷鸣研究组的最新研究成果“Dimerization of SLX4 contributes to functioning of the SLX4-nuclease complex”,该研究揭示了SLX4的同源二聚化影响范可尼贫血症相关核酸酶复合物的分子机制。
范可尼贫血症是一种遗传性疾病,其患者表现为骨髓缺陷,易患癌症,易受DNA交联影响等症状。SLX4(又称为FANCP)是范可尼贫血症相关的一个重要蛋白,其多个氨基酸位点的突变都会导致该疾病的发生。在细胞中,SLX4可以协调组装一个由SLX1、MUS81、XPF等多个蛋白所形成的核酸酶复合物,在维持基因组稳定性的众多生理过程中发挥重要作用,这其中包含有DNA双链间交联修复,DNA复制,同源重组中间产物的核酸处理,基因组复制困难区域的协调以及端粒的维持等等。SLX4是一个由多个结构域构成的蛋白质,这些特定的结构域不仅能够促进SLX4识别并结合涉及DNA修复的众多蛋白质,而且可以协调这些蛋白质在特定区域的有效定位及功能发挥。尽管SLX4作为一个脚手架蛋白能够协调上述核酸酶复合物的正确组装与定位,但是该过程所涉及的分子机制并不清楚。
在本研究中,Jinhu Yin、万兵兵和Jaya Sarkar及其同事在雷鸣研究员和Yie Liu教授的指导下,揭示了SLX4功能的正常发挥严格依赖于其同源二聚体的形成。他们成功的解析了SLX4负责同源二聚化的结构域的晶体结构,阐明了SLX4负责形成同源二聚体的关键相互作用位点。他们发现破坏SLX4二聚化的形成会导致其功能的丧失,进一步影响定位于端粒的功能性核酸酶酶复合物的有效组装。这会导致端粒的复制、同源重组及长度稳态等的异常,引发端粒缺陷,从而使得整个基因组的稳定性受到潜在的影响。上述研究成果将会帮助人们进一步了解范可尼贫血症形成和发展的相关分子机制。
Jinhu Yin、万兵兵和Jaya Sarkar是该工作的共同第一作者,中科院上海生化与细胞所国家蛋白质科学中心(上海)的雷鸣研究员和美国国立卫生院的Yie Liu教授是该工作的共同通讯作者。该研究工作受到国家科技部,国家自然科学基金委,中科院战略性先导科技专项(B类)和美国美国国立卫生院的经费资助。
论文链接:http://nar.oxfordjournals.org/content/early/2016/04/29/nar.gkw354.long
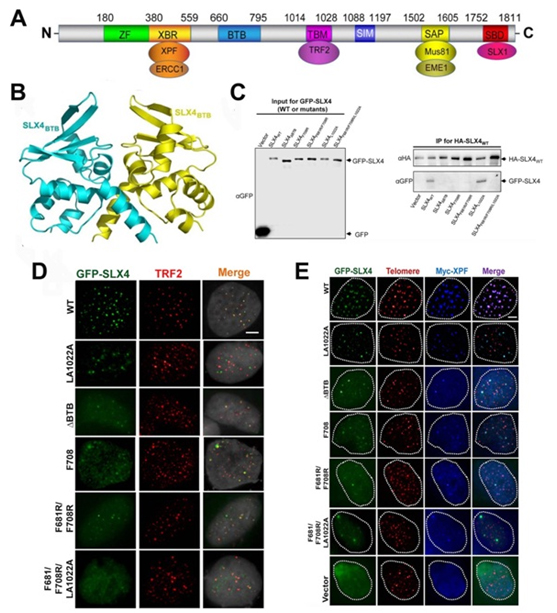
图示:SLX4的同源二聚化影响范可尼贫血症相关核酸酶复合物的分子机制。(A)人源SLX4蛋白的结构域组成。(B)同源二聚化SXL4的BTB结构域的整体结构。(C)在细胞内,BTB结构域中某些重要氨基酸突变影响SLX4的寡聚化。(D)内源SLX4敲除的U2OS细胞中,不同外源GFP-SLX4蛋白表达对细胞核集落形成以及与TRF2蛋白共定位的影响。(E)内源SLX4敲除的U2OS细胞中,不同外源GFP-SLX4蛋白与内源核酸酶XPE共定位的情况。