孙兵研究组揭示细胞外基质蛋白1(ECM1)保护多发性硬化功能及机制
来源:
时间:2016-07-27
6月17号,国际学术期刊
The Journal of Immunology在线发表了
中国科学院上海生命科学研究院生物化学与细胞生物学研究所孙兵研究组及合作者的题为“Novel Function of Extracellular Matrix Protein 1 in Suppressing Th17 Cell Development in
Experimental Autoimmune Encephalomyelitis”的最新研究进展。该研究成果揭示了细胞外基质蛋白1(Extracellular Matrix Protein 1)对小鼠实验型自身免疫性脑脊髓炎(Experimental Autoimmune Encephalomyelitis,EAE)的保护性和治疗性的作用,这为开发治疗人类多发性硬化疾病新型药物提供了一个潜在的药物候选分子。
孙兵研究组之前研究发现ECM1是一个II型T辅助细胞(Th2)所分泌的糖蛋白,在免疫系统中,ECM1可以通过影响趋化因子受体S1P1的方式调节成熟的免疫细胞迁移出淋巴结并到达炎症反应部位。由于在免疫系统中,不同亚群的Th细胞以及其特异性的分泌分子具有相互拮抗抑制的作用,所以ECM1是否能够调控其他Th亚群细胞的发育以及其所介导的自身免疫疾病并不清楚。
在孙兵研究员指导下,博士研究生苏攀等对ECM1蛋白在Th1/Th17细胞所介导的人多发性硬化症(MS)以及其疾病动物模型EAE中的功能进行了深入的研究。
研究人员首先使用昆虫细胞介导的真核表达系统成功表达具有正确修饰和蛋白活性的ECM1-Fc重组蛋白,并使用重组ECM1-Fc蛋白作为治疗药物在EAE疾病诱导的早期尾静脉注射给药,发现ECM1蛋白可以非常有效的抑制小鼠EAE疾病的发生和发展过程。研究人员通过长达5年的努力,建立了体外DC-T细胞共培养系统,构建了ECM1转基因小鼠,发现ECM1蛋白可以抑制EAE小鼠体内致病性Th17细胞的产生进而抑制EAE疾病的发生。机制研究发现,ECM1蛋白可以与DC细胞表面的整合素αv分子相互作用,这种相互作用封闭了整合素αv分子与前体TGF-b的相互结合,使细胞外前体的TGF-b不能够被整合素αv剪切活化,从而抑制了细胞外活性TGF-b的产生,进而导致Th17细胞的分化过程被抑制。研究还发现,不仅外源的重组ECM1蛋白可以治疗EAE,内源性的ECM1蛋白也同样具有治疗EAE的效果。
该研究有助于进一步深入理解人类多发性硬化症的发病机理,为多发性硬化症以及其他Th17细胞所介导的自身免疫性疾病的治疗提供了新的药物候选。
该工作是由生化与细胞所孙兵研究组、美国NIH朱锦芳教授课题组和浙江大学吴志英教授课题组合作完成的,并得到国家自然科学基金委、国家科技部973计划、中国科学院与诺和诺德合作项目的经费支持。该工作的数据收集工作得到生化与细胞所公共技术服务中心细胞分析技术平台、动物实验技术平台、分子生物学技术平台的大力支持。
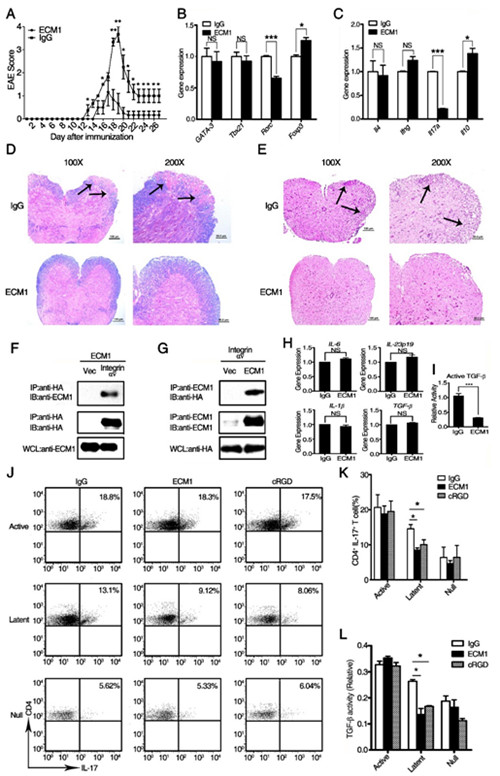
ECM1抑制Th17细胞的形成和EAE疾病的发生。(A)ECM1蛋白处理抑制小鼠EAE疾病的严重程度;(B)ECM1蛋白抑制Th17细胞关键转录因子RORC的表达。(C)ECM1蛋白处理抑制Th17细胞特异性细胞因子il-17a的表达。(D)Fast Blue染色检测不同处理组小鼠脊髓组织损伤程度;(E)H&E染色检测不同处理组小鼠脊髓组织炎症水平;(F和G)ECM1与整合素αv相互作用;(H)ECM1不影响DC细胞TGF-b、IL-6、IL-23和IL-1b的基因表达;(I)ECM1抑制DC细胞培养上清中活性TGF-b的水平;(J)ECM1抑制DC-T细胞共培养条件下Th17细胞的分化;(K)DC-T细胞共培养Th17细胞分化程度量化;(L)共培养上清中活性TGF-b的水平。
