1月13日,国际学术期刊Cell Research在线发表了中国科学院上海生物化学与细胞生物学研究所惠静毅和胡荣贵研究组题为“SPSB1-Mediated HnRNP A1 Ubiquitylation Regulates Alternative Splicing and Cell Migration in EGF Signaling”的合作研究成果。该研究报道了RNA结合蛋白hnRNP A1在EGF刺激细胞后发生泛素化修饰,并通过影响Rac1基因的可变剪接介导了EGF信号促进的细胞迁移。该项工作较为完整地揭示了之前未被发现的RNA结合蛋白泛素化修饰在信号转导通路中的机制与功能,为认识RNA结合蛋白这类重要蛋白在生理和病理过程中的调控作用提供了新的研究方向。
mRNA的可变剪接是一种增加基因组多样性和调控基因表达的重要机制。信号转导在机体应答外界刺激和维持稳态过程中发挥重要功能。尽管一些研究工作显示可变剪接受到细胞外信号的严格调控,但是目前的研究报道对细胞是如何将胞外信号传入细胞核内产生可变剪接变化的认识还是片段化的,尤其对信号转导调控可变剪接的生物学功能的研究还非常有限。
EGF信号通路在个体发育与肿瘤发生发展中具有重要功能。本项研究针对这一信号通路,博士研究生王丰、傅兴博士、陈朋博士以及其他同事首先利用高通量测序技术确定了EGF刺激所引起的可变剪接事件和可能参与的剪接调控蛋白,从而发现了EGF能够引起RNA结合蛋白hnRNP A1的泛素化修饰。通过采用酵母双杂交方法,鉴定到SOCS box蛋白家族成员SPSB1能够结合hnRNP A1,并且是EGF诱导hnRNP A1泛素化的充分和必要条件。EGFR抑制剂能够阻碍SPSB1表达上调和hnRNP A1泛素化。进一步的实验说明SPSB1通过招募Elongin B/C-Cullin E3泛素连接酶复合物在hnRNP A1蛋白第183和298位赖氨酸残基上发生K29型非降解性的多聚泛素化修饰。更重要的是,SPSB1介导的hnRNP A1泛素化对EGF诱导的细胞迁移具有促进作用。EGF诱发hnRNP A1泛素化后导致其与Rac1 pre-mRNA的结合减弱;同时,EGF激活SR蛋白激酶(SRPK),促进SR蛋白活化。这两方面因素一起促进了Rac1可变外显子3b的引入,导致Rac1的一种剪接异构体Rac1b表达上调,而Rac1b具有能够促进细胞迁移的能力。
该研究的质谱样品制备、泛素化位点鉴定以及泛素连接类型确定由黄超兰研究员指导研究组成员吴萍完成。样品分析和泛素化位点解析使用了先进的液相串联质谱技术和世界领先的蛋白组学数据解析软件IP2 (Integrated Proteomics Pipeline)。这些研究数据的获得为确定EGF信号刺激引起hnRNP A1泛素化修饰这一关键结果提供了有力证据。
该工作还得到了中科院-马普学会计算生物学伙伴研究所王泽峰研究员及其研究组成员樊晓娟在生物计算方面的支持以及生化与细胞所季红斌研究员和其研究组成员的帮助。在研究数据收集过程中得到生化与细胞所公共技术服务中心分子和细胞平台的帮助以及中科院、国家自然科学基金委、国家科技部提供的经费支持。
文章链接:http://www.nature.com/cr/journal/vaop/ncurrent/full/cr20177a.html
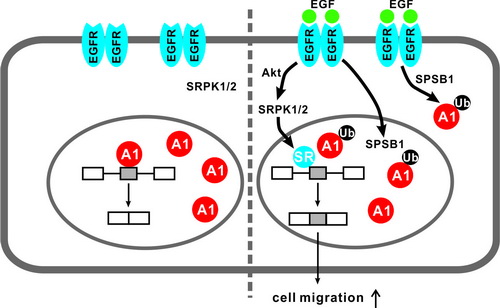
工作模型:当EGF刺激细胞后,SPSB1表达上调介导了hnRNP A1的泛素化,并与EGF诱导的SRPK激活一起,增加Rac1剪接异构体的表达,从而促进了细胞的迁移。