1月20日,国际知名学术期刊Cell Research在线发表了中国科学院上海生物化学与细胞生物学研究所国家蛋白质科学中心(上海)丛尧研究组的最新研究成果“High-resolution cryo-EM structure of the proteasome in complex with ADP-AlFx”。该研究首次解析了蛋白酶体在激活状态下的近原子分辨率冷冻电镜三维结构,阐明了蛋白酶体在ATP驱动下的激活变构调节机制,为深入理解其协助底物去折叠、转运及降解的分子机制提供重要结构基础。博士研究生丁占玉为论文第一作者,丛尧研究员为论文通讯作者。
泛素-蛋白酶体系统是真核细胞内最为主要的蛋白质降解途径,细胞中约90%受到损伤或错误折叠的蛋白质经由该途径降解。蛋白酶体参与调控众多生物进程(如蛋白质质量控制、细胞周期维持、基因表达调控等),其功能的异常与癌症、自身免疫病和神经退行性疾病等人类重大疾病密切相关,是重要的药物靶标。26S蛋白酶体是由至少33个不同亚基组成的超大分子机器,其执行底物降解功能的过程与其在ATP驱动下的动态构象变化密切相关。但是由于激活状态下蛋白酶体高分辨率结构的缺失,至今对蛋白酶体在ATP驱动下被激活并执行底物降解功能的结构机制了解仍十分有限。
丛尧研究员带领博士研究生丁占玉等实验室成员,依托国家蛋白质科学中心(上海)的先进冷冻电镜设施,解析了蛋白酶体结合ADP-AlFx(模拟ATP水解过渡态)的冷冻电镜结构,并表明该结构处于激活状态,首次将蛋白酶体激活状态结构推进至近原子分辨率水平。该结构表明proteasome-ADP-AlFx处于全新的构象状态,尤其是AAA-ATPase六元环发生明显构象变化,且与底物去折叠及转运密切相关的pore loop亦呈现重排。首次观测发现蛋白酶体结合核苷酸的不对称性,激活状态下只有四个相邻AAA-ATPase亚基能同时结合核苷酸,揭示核苷酸的结合状态与蛋白酶体的活性状态直接相关。有趣的是另外两个未结合或部分结合核苷酸的亚基Rpt2和Rpt6的构象变化最为显著,可能是所有AAA-ATPase亚基对ATP水解的集中体现,预示其在底物降解过程中的重要作用。同时揭示了存在更为复杂的蛋白酶体20S门控打开机制。该研究阐释了蛋白酶体在核苷酸驱动下被激活,发生变构调节从而产生机械力以协助底物去折叠及降解的新机制,为探索相关疾病的诊治手段提供结构基础。
该研究得到生化与细胞所周金秋研究员和周兆才研究员的大力支持。X射线小角散射数据由生化与细胞所李娜博士和张荣光研究员帮助完成。该研究得到国家蛋白质科学中心(上海)冷冻电镜系统,数据库与计算分析系统、X射线小角散射线站、质谱系统、规模化蛋白质制备系统的大力支持,部分数据分析基于承蓝冷冻电镜云平台完成。研究得到中国科学院、国家自然科学基金委、国家科技部和上海市科委等的资助。
文章链接:http://www.nature.com/cr/journal/vaop/ncurrent/full/cr201712a.html
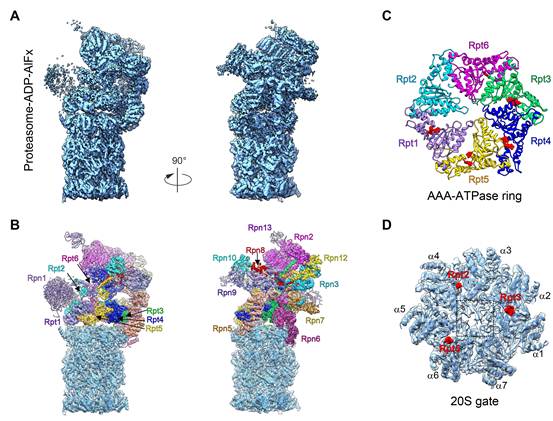
(A-B) 蛋白酶体结合ADP-AlFx的近原子分辨率冷冻电镜三维结构及模型。(C) 全新构象的AAA-ATPase环及不对称的核苷酸结合状态。(D) 20S顶视图表明门控依然关闭。