丁建平研究组揭示人源NAD依赖型异柠檬酸脱氢酶αγ二聚体别构调节的分子机制
来源:
时间:2017-03-01
1月18日,国际学术期刊Scientific Reports在线发表了中国科学院分子细胞科学卓越创新中心/上海生物化学与细胞生物学研究所分子生物学重点实验室、国家蛋白质科学中心(上海)丁建平研究组的最新研究成果:“Molecular mechanism of the allosteric regulation of the ag heterodimer of human NAD-dependent isocitratedehydrogenase”。该研究工作揭示了人源NAD依赖型异柠檬酸脱氢酶(NAD-IDH)ag二聚体别构调节的分子机制。
IDH是一类广泛存在于生物体中的酶家族,该酶以NADP或NAD为辅酶催化异柠檬酸(isocitrate,ICT)氧化脱羧生成a-酮戊二酸。真核生物具有NADP和NAD依赖型的两种IDH。NADP依赖型IDH(NADP-IDH)在细胞浆、线粒体和过氧化物酶体中均有分布,被发现主要在细胞抗氧化损伤、活性氧自由基的解毒以及脂肪和胆固醇合成中起重要作用;而NAD-IDH定位在线粒体内,被认为是三羧酸循环的限速酶。
丁建平研究组在真核生物异柠檬酸脱氢酶的结构和功能方面进行了长期的研究工作,先后测定了人胞浆NADP-IDH(IDH1)和酵母线粒体NADP-IDH(Idp1p)与辅酶、底物、金属离子和产物等蛋白复合物的晶体结构,以及人源IDH1肿瘤相关突变体(R132H)的结构,并开展了生化和功能研究。这些工作揭示了该类酶发挥生物学功能及其导致疾病发生的分子基础
(J. Biol. Chem., 2004; Protein Sci., 2008; Cell Res., 2010)。哺乳动物NAD-IDH是由
a、b和g三种亚基以2:1:1的比例组装而成,
a亚基是催化亚基,参与底物、辅因子、金属离子的结合,而
b和
g亚基被认为是调节亚基,可能具有结合调节因子的能力。前期研究工作发现,哺乳动物NAD-IDH可以受到柠檬酸(citrate,CIT)、ADP等因子的别构调节从而改变自身对底物ICT的亲和力,但不影响最大反应速率。
a和
b亚基或者
a和
g亚基可以形成基本的结构单元、从而进行八聚体全酶的组装,并分别具有一定的活力,但是两种调节亚基在结构和功能上的差异,以及它们进行别构调节的机制还不清楚。
丁建平研究组的助理研究员马腾飞等人对人源NAD-IDH中
ag二元复合物进行了深入的结构和功能研究。解析了4种野生型a
g二元复合物结合不同配体的高分辨率晶体结构(包括
g亚基不结合配体的结构,
g亚基结合Mg
2+和CIT的结构,
g亚基结合Mg2+、CIT和ADP的结构,
g亚基结合Mg
2+、ICT和ADP的结构)以及一种
ag突变体
g-K151A结合Mg
2+、CIT和ADP的结
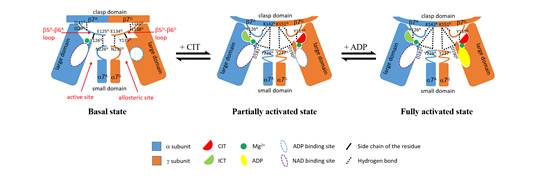
构。结构分析表明,CIT、ADP和Mg
2+结合在
g亚基别构位点中相邻的位置。CIT的结合会引起别构位点的构象变化,并通过二聚体相互作用界面将这种构象变化传递到催化中心,从而提高酶对底物的结合力,使酶具有较高的催化效率。ADP的结合不会引起进一步的构象变化,但是通过Mg
2+介导的相互作用稳定了CIT在别构位点的结合,从而实现了ADP和CIT之间的协同激活作用。ICT也可以结合在CIT的结合位点,引起类似的构象变化,但是它的激活作用较弱。该工作首次从分子水平上阐明了
ag二元复合物的别构调节机制,极大地推进了人源NAD-IDH全酶的结构功能研究。
国家蛋白质科学研究设施(上海)19U1线站的工作人员在晶体衍射数据收集为本研究提供支持与帮助。该项研究工作得到了国家自然科学基金委、国家科技部和中国科学院的经费支持。
αγ二聚体别构调节机制的示意图