高大明研究组发现胞外信号通过ERK激酶磷酸化Lin28 调控P19细胞增殖及分化
来源:
时间:2017-03-17
2月8日,国际学术期刊Journal of Biological Chemistry在线发表了中国科学院生物化学与细胞生物学研究所高大明研究组题为“Extracellular Signal-regulated Kinases (ERKs) Phosphorylate Lin28a Protein to Modulate P19 Cell Proliferation and Differentiation”的最新研究成果。
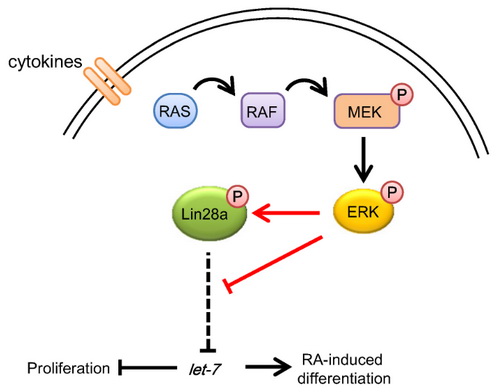
干细胞的增殖和分化是两个紧密相关的过程,而且这两个过程均受胞外信号的调控。其中,MAPK-ERK信号通路在控制细胞的增殖和分化中扮演了关键的角色。活化的MAPK-ERK信号可以促使细胞更容易通过细胞周期的G1期早期,如果MAPK信号持续活化,则经常会诱导干细胞的分化,从而将增殖与分化联系起来。Lin28a是一个高度保守的RNA结合蛋白,于1984年首次在秀丽隐杆线虫中被报道,并且参与了细胞增殖和细胞多潜能性的调控。Lin28a发挥功能的主要机制是通过与let-7家族miRNA的前体结合,抑制了其成熟,从而进一步影响了let-7的下游靶基因表达,已知受其调控的基因包括c-Myc,Ras,cyclin D1以及Lin28a本身等。
在高大明研究员的指导下,博士研究生刘相元通过免疫共沉淀-质谱的方法鉴定出了Lin28a的关键磷酸化修饰位点Ser200,并通过筛选发现Erk1/2介导了Ser200位的磷酸化。之后,研究者通过CRISPR/Cas9技术在P19 畸胎瘤干细胞中将lin28a基因Ser200的编码位置引入了点突变,获得了Lin28a Ser200Ala(磷酸化缺失) 和Ser200Asp(磷酸化模拟) 敲入细胞系。与野生型的P19细胞和Ser200Asp敲入细胞系相比,Ser200Ala敲入细胞系增殖速度更快,在RA诱导时分化速度则更慢。而Ser200Asp敲入细胞系增殖速度最慢,RA诱导时分化速度最快。进一步实验发现, Lin28a被磷酸化后,抑制let-7成熟的能力减弱,从而使let-7下游的靶基因cyclinD1下调,P19 EC细胞增殖变慢并开始分化。这项研究揭示了Lin28a翻译后修饰对Lin28a功能的重要调控作用,深化了对干细胞增殖和分化的分子机制的认识。
该研究工作得到了吴立刚研究员、陈玲玲研究员以及上海药物所周虎研究员的大力协助,并得到了国家自然科学基金委、科技部的研究经费支持。
ERK介导了Lin28a的Ser200位的磷酸化,并通过let-7依赖的途径下调cyclinD1,并调控了P19细胞的增殖和分化。