李劲松研究组建立一种快速分析致死基因在不同组织中功能的新方法
来源:
时间:2017-04-25
4月21日,国际期刊杂志
Cell Research以Article的形式发表了
中国科学院生物化学与细胞生物学研究所李劲松研究组和中国科学院神经科学研究所于翔研究组的最新研究成果:“CRISPR-Cas9-mediated genome editing in one blastomere of two-cell embryos reveals a novel Tet3 function in regulating neocortical development”,该研究利用CRISPR/Cas9技术和细胞谱系示踪技术对小鼠两细胞胚胎中的单个卵裂球进行了基因敲除,一步法获得了Tet3基因敲除的健康嵌合小鼠,并对Tet3基因敲除后大脑皮层和海马神经元的突触传递进行了探究。该方法是一种快速地分析致死基因在各个组织器官中功能的新方法。
DNA双加氧酶Tet3是Tet蛋白家族的一个重要成员,之前的研究发现, Tet3全身性敲除小鼠有部分可以发育到出生,但是出生后24小时内死亡。因此,若想研究Tet3在成年小鼠中的功能,需要借助Cre/loxP系统在不同的组织中进行特异性的敲除。这就带来一系列的问题:待研究的组织是否有特异性的Cre小鼠资源;若想在不同组织中研究基因的功能,则需要不同的Cre小鼠;条件性敲除小鼠交配周期长。
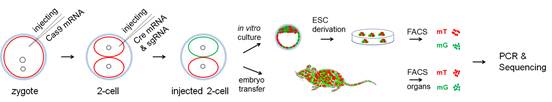
基于此,李劲松团队提出了一种基于嵌合体的快速分析致死基因潜在功能的方法。首先,他们在mT/mG小鼠胚胎的一细胞时期(受精卵时期)注射了Cas9 mRNA,而后在两细胞时期,随机地在两细胞的其中一个卵裂球注射Cre mRNA和Tet3 sgRNAs。将这些注射过的胚胎移植到假孕小鼠体内,就可以获得Tet3敲除的嵌合鼠,这些嵌合鼠可以正常成活,并且在各个组织器官中都有红色/绿色两种细胞存在,其中红色细胞是野生型,绿色细胞是Tet3敲除的。为简化基因型鉴定同时为保证敲除的成功率,研究人员进一步将多个sgNRAs(3-4个)注射到单个卵裂球中,这种策略得到的小鼠很容易通过PCR条带鉴定出是否有大片段敲除,同时可以把一整个外显子删除掉保证了敲除的成功率。他们对这些嵌合体小鼠的大脑进行分析,发现Tet3敲除并不影响大脑皮层主要细胞类型的发育和分化。研究人员进一步通过对邻近的野生型和Tet3敲除细胞进行成对电生理记录,发现Tet3敲除之后,小鼠大脑皮层和海马锥体神经元的兴奋性与抑制性突触传递均发生了显著性的改变,表现为兴奋性突触传递的上调和抑制性突触传递的下调。研究结果提示Tet3在大脑不同脑区神经环路的发育中起到了重要的作用。
该技术方法的优越性主要在于:对于致死基因,可以一步法获得嵌合小鼠,用于探究该基因在不同组织器官中的作用;在同一个个体内,野生型细胞是基因敲除型细胞的严格对照;基因敲除型细胞可以零星地散布在各个组织中,有助于研究基因的自主性和非自主性功能。
李劲松组博士生汪凌波和于翔组博士生李敏寅为本文的共同第一作者。感谢徐国良研究员、景乃禾研究员、黄超兰研究员等人以及细胞平台的大力支持和帮助。该论文得到了中科院、国家科技部及国家自然科学基金委的经费支持。