侯法建研究组揭示Ube2D3和Ube2N参与RIG-I诱导MAVS聚集的生化机制
来源:
时间:2017-05-08
5月4日,国际学术期刊Nature Communications在线发表了中国科学院生化细胞所侯法建研究组的最新研究成果“Ube2D3 and Ube2N are essential for RIG-I-mediated MAVS aggregation in antiviral innate immunity”。该工作揭示了宿主细胞内模式识别受体分子RIG-I的激活机制,为更深入地理解RIG-I分子的工作机制奠定了研究基础。
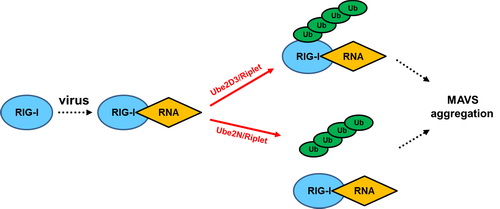
天然免疫是机体抵御病原体侵染的第一道防线,其中病毒RNA受体RIG-I所介导的信号转导通路则在细胞响应RNA病毒侵染的免疫应答过程中起到关键性的作用。此前的研究表明,RIG-I分子在识别入侵的病毒RNA分子之后会解除自身的抑制状态,释放其N端CARD结构域。RIG-I的CARD结构域和线粒体蛋白质MAVS相互作用并且诱导其聚集(Cell,2011),MAVS随之解除自身抑制的状态从而激活下游转录因子NF-κB和IRF3 (Nat Commun,2015),诱导I型干扰素的表达,并最终清除入侵的病毒。
该研究首先建立了体外实验体系来研究诱导MAVS聚集的必需因子,发现泛素连接酶(E3) Riplet是RIG-I识别病毒RNA并激活MAVS所必须的,而此前领域内广泛认同的泛素连接酶TRIM25并没有直接参与这一生化过程。随后,通过蛋白质分离纯化和质谱分析鉴定出协助Riplet发挥抗病毒功能的泛素结合酶(E2) Ube2D3和Ube2N,这两种E2共同参与了Riplet激活RIG-I并诱导MAVS聚集的信号转导过程。进一步的分子机制研究发现, Ube2D3-Riplet组合促进RIG-I的CARD结构域的K63位多聚泛素化的共价修饰,而Ube2N-Riplet组合则促进非锚定的K63位多聚泛素链的合成。最终,K63位链接的多聚泛素链和RIG-I共同诱导MAVS的多聚化,启动抗病毒天然免疫反应。
硕博连读生石玉衡、苑博峰和朱文婷为本文共同第一作者,合作完成者为北生所陈涉博士,研究经费来自基金委和中科院。同时得到的帮助和支持来自浙江大学夏总平教授,武汉大学张晓东教授,UT MD Anderson Cancer Center的孙少聪教授,生化与细胞所陈德桂研究员、王红艳研究员、邱颖同学和周金秋研究员。该研究工作还得到生化与细胞所分子生物学技术平台和细胞分析技术平台的支持。