胡荣贵研究组发现泛素信号调节细胞自噬、感应泛素胁迫的新机制
来源:
时间:2017-05-18
5月5日,学术期刊
Cell Research正式发表了中国科学院生物化学与细胞生物学研究所
胡荣贵研究组的最新研究成果“Ubiquitylation of p62/Sequestosome1 Activates Its Autophagy Receptor Function and Controls Selective Autophagy Upon Ubiquitin Stress”。本项研究阐述了泛素信号在自噬受体水平调控细胞自噬的新机制,揭示了细胞内起核心作用的自噬受体蛋白p62作为感应泛素胁迫感应器调控细胞选择性自噬活性,应对药物、热激(heat shock)等生理病理相关胁迫的基本的分子机制。
自上世纪六十年代,泛素(Ubiquitin, Ub)分子被首次发现以来,人们发现泛素作为一类重要信号分子,通过泛素激活酶(E1)、泛素偶联酶(E2)、泛素连接酶(E3)顺序催化的泛素化修饰(Ubiquitylation或ubiquitination)以及去泛素化酶参与的去泛素化修饰(deUbiquitylation或deubiquitination),以可逆、可诱导的方式调节细胞内几乎所有重要的生命活动。泛素化信号的异常与肿瘤、神经退行性疾病、神经认知遗传缺陷如孤独症等密切相关,但其机理目前的认识却尚处于不断深入的阶段。在真核生物中都可有多个基因编码泛素蛋白,是细胞内含量最高的基因编码的产物之一达到近500μM。在细胞内主要以自由和偶联的两种方式存在,多项研究表明,胞内泛素分子的丰度及稳态变化在细胞内外不同生理病理刺激的作用下,呈现复杂多样的变化,被统称为泛素胁迫(Ub stress)。例如,当细胞处于热激、药物处理、衰老、病原体感染等状态下,细胞内的泛素基因的转录水平显著变化,在亚细胞水平的稳态分布也会发生异常改变。研究表明,胞内泛素水平异常也会影响从酵母到人类细胞或机体生命活动的诸多方面,例如泛素基因突变或水平不足的小鼠,小鼠则表现为神经退行性疾病症状以及肝脏发育缺陷;泛素过表达的细胞则表现出类干细胞的某些特征、影响肿瘤细胞的药物反应,但是分子机制一直都不清楚。
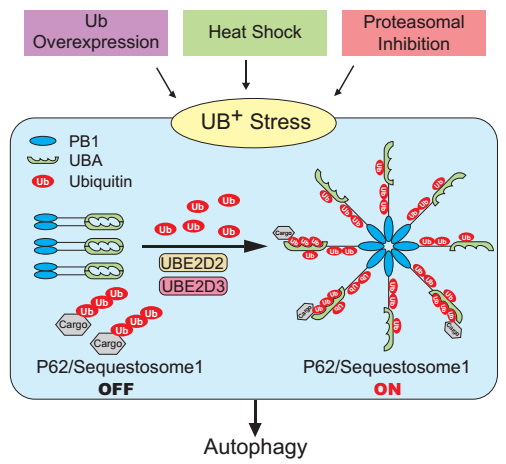
胡荣贵研究组的彭虹博士、杨娇博士作为共同第一作者,首先发现泛素胁迫在接受化疗的肿瘤病人的细胞内真实存在。他们接下来进一步定义了泛素胁迫的概念,将多种影响细胞内泛素稳态的条件根据泛素总体水平被上调还是下调分别定义为正向泛素胁迫(Ub+ stress)和泛素负向胁迫(Ub- stress)。 研究发现,正向泛素胁迫如蛋白酶体抑制剂类药物的肿瘤化疗或细胞处于热激状况时,细胞内泛素水平明显上升并伴随有依赖p62的细胞选择性自噬的激活;而泛素负向胁迫条件下则细胞自噬被严重抑制。
进一步研究发现,通常情况下,细胞内最重要的自噬受体蛋白之一p62,通常由于N端的PB1结构域、C端的UBA结构域间的分别结合形成稳定的二聚或多聚体而处于不能与底物结合的自我抑制 (self-inhibitory) 状态,而使细胞内自噬活性保持较低的水平。他们首次发现P62可以与两类E2泛素偶联酶(UBE2D2/UBE2D3)发生特异性的直接相互作用,并发生自泛素化修饰。当细胞内的泛素水平显著升高时,p62会更加显著地发生E2-依赖的泛素化,经泛素化修饰的p62蛋白构象会发生改变,C-端的UBA二聚体被打开,而处于可以与泛素化底物结合的活化“active”状态,从而更有效地募集结合被K63-连接的多泛素链修饰的自噬底物。这些研究成果首次揭示p62不依赖与E3的自泛素化修饰,发挥感受泛素胁迫的效应器(Ub stress sensor)的功能,并调控细胞自噬,介导细胞对肿瘤的药物化疗药物敏感性、热激效应以及外源微生物侵染等的新的分子机制。
该研究组之前报道了具有肿瘤抑制活性的泛素连接酶HACE1可以通过泛素化自噬受体OPTN,调控自噬受体复合物形成,增加细胞自噬途径降解的通量并抑制多种肿瘤发生发展的机制(Liu et al Cancer Cell 2014)。在揭示了泛素信号调节自噬复合物形成的基础上,本研究在自噬受体层面揭示了泛素信号调节自噬受体功能开关,调控细胞反应的新机制,不仅帮助人们从机制上理解此前困惑已久的一系列生物学现象,为研究细胞应对各种刺激的分子机制提供了新的研究视角,也可能有助于优化设计通过干预细胞自噬提高肿瘤诊疗效果的方案。
绝大多数实验室在研究胞内特定蛋白质泛素化及其功能性影响时都会涉及到过表达带标签的泛素,而本研究发现,在几乎所有研究的细胞类型内,如果过表达泛素蛋白,无论有无标签,到一定的水平都可以导致人为的泛素正向胁迫而激活细胞自噬。很显然,无论泛素领域内外的人们,都普遍忽略了自噬被人为激活的可能,从而在解释很多实验现象时,欠缺完整考虑甚至造成完全的误导。本项研究明确提醒人们,在研究胞内泛素信号相关的生物学问题时,必须避免因盲目地过表达泛素而在自己的实验体系内人为激活细胞自噬。
研究工作得到哈佛医学院Daniel Finley教授,歌德大学法拉克福生化所的Ivan Dikic教授,新泻大学小松雅明教授,特别是北京军事医学科学院张学敏院士及团队、生化与细胞所何勇宁、黄旲、高大明、王红艳、惠利健研究员的大力支持。电镜和动态光散射数据由生化与细胞所何勇宁研究员课题组的李光一博士帮助完成。p62蛋白二聚体结构分析由黄旲研究员指导完成。 质谱数据由曾嵘研究员课题组成员李青润博士以及黄超兰研究员等协助完成。临床样本收集方面得到长征医院血液科侯健教授团队和华山医院中心实验室张弢博士的大力支持。实验数据收集过程中得到生化与细胞所公共技术服务中心分子和细胞平台的技术支持。研究组也感谢中科院分子细胞科学卓越创新中心、中科院先导计划(B类)、国家自然科学基金委医学部的国家杰出青年基金和生命学部项目基金支持、国家科技部项目、信号传导网络协同创新中心提供的经费等支持。
自噬受体蛋白p62感应
正向泛素胁迫(Ub
+ Stress),通过不依赖于E3的自泛素化,由自我抑制状态被激活,调控细胞选择性自噬功能的分子机制示意图。