王恩多研究组揭示含编校功能缺陷的亮氨酰-tRNA合成酶的酵母细胞保护机制
来源:
时间:2017-06-05
6月3日,国际学术期刊Nucleic Acids Research在线发表了中国科学院生物化学与细胞生物学研究所王恩多研究组题为“Self-protective responses to norvaline- induced stress in a leucyl-tRNA synthetase editing-deficient yeast strain”的最新研究成果。
氨基酰-tRNA合成酶 (aminoacyl-tRNA synthetase,aaRS)的编校功能负责水解误活化或误氨基酰化的氨基酸,对蛋白质合成进行质量控制。一旦某种特定的aaRS的编校功能受损,会导致非对应氨基酸误掺入蛋白质,引起蛋白质误折叠、合成失控。为了应对aaRS编校功能缺陷引起的压力,细胞也进化出一系列保护性应对机制。
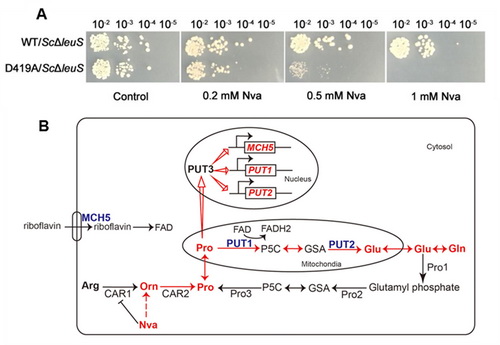
在王恩多研究员的指导下,博士研究生纪泉泉和方志鹏等人证明正缬氨酸(norvaline,Nva)是对酿酒酵母亮氨酰-tRNA合成酶(Saccharomyces cerevisiae leucyl-tRNA synthetase, ScLeuRS)有最大胁迫的非对应氨基酸。Nva可误掺入LeuRS编校功能缺陷的酵母细胞(D419A/ScΔleuS)的蛋白质组,导致细胞生长速度变慢、甚至死亡。细胞上调Hsp70帮助错误折叠蛋白质重折叠。此外,研究首次报道D419A/ScΔleuS细胞可将部分“毒性”的Nva转换成“非毒性”的氨基酸(Pro, Glu和Gln),降低活性氧簇(ROS)从而降低Nva对D419A/ScΔleuS细胞的胁迫,保护细胞。
该工作得到中国科学院、国家科技部、国家自然科学基金委的项目资助。
A. Leu的类似物Nva抑制LeuRS编校缺陷型酵母细胞(D419A/ScΔleuS)的生长
B. D419A/ScΔleuS细胞中Nva转化成非毒性氨基酸的代谢示意图