许琛琦研究组揭示静电作用介导Src家族激酶底物选择性的分子机制
来源:
时间:2017-06-29
T细胞活化依赖于细胞表面的T细胞抗原受体(T-cell receptor, TCR)。TCR可以识别“自我”和“非我”抗原,并根据抗原的特质引发特异性的下游信号通路,从而使得T细胞产生特异性分化并获得不同的效应功能。TCR复合体有4种CD3信号链(CD3γ/δ/ε/ζ),共携带了20个酪氨酸磷酸化位点。不同的抗原刺激会引起不同的TCR磷酸化模式,从而引发特异性的免疫应答反应。因此,阐明TCR的磷酸化机制是理解获得性免疫为什么具有特异性的关键所在。
为了探究这一科学问题,在许琛琦研究员的指导下,硕士研究生李伦一、博士后郭兴东、博士研究生施小山、硕士研究生李昌庭等人运用多种技术手段分析了Lck磷酸化四种CD3信号链的过程。他们发现Lck具有明显的底物选择性,即更倾向于携带正电荷的CD3e链。生物化学与生物物理的实验发现Lck的Unique domain(UD)与CD3e链胞内区的碱性氨基酸富集区(BRS)发生静电相互作用,从而高效地介导了磷酸化过程。将BRS区替换到其他的CD3链后,Lck对它们的磷酸化水平明显提高。接着,他们在293FT细胞中重构了整个TCR复合体及其磷酸化调控蛋白,该系统可以使得他们能够排除下游信号反馈调控来独立地研究TCR磷酸化事件。他们发现利用突变削弱CD3e-BRS/Lck-UD相互作用后,TCR复合体的整体磷酸化水平会明显降低,说明了CD3e招募Lck对TCR磷酸化的起始非常关键。
许琛琦研究员的前期工作发现了CD3e的BRS区可以与细胞质膜的酸性磷脂相互作用,从而使得整个CD3e的胞内区被屏蔽在膜脂双层中(Cell 2008)。基于以上发现,这种膜屏蔽机制既屏蔽了CD3e的酪氨酸位点,同时也阻止其BRS区与Lck的相互作用,达到抑制TCR整体磷酸化的效果。在T细胞被抗原活化后,抗原结合引起TCR形变可能使得CD3e胞内区从膜上解离;或者钙离子通过中和酸性磷脂负电荷的方式使得未直接接触抗原的TCR中的CD3e胞内区从膜上解离(Nature 2013)。不同亲和力的抗原会引发不同程度的CD3e膜解离(Cell Res 2017),因此会带来不同的Lck招募程度和TCR的磷酸化程度。
该项研究工作阐明了TCR磷酸化起始的关键机制,同时揭示了Src家族酪氨酸激酶具有高度底物选择性这一现象。由于Src家族在多种细胞类型中都发挥重要作用,该项工作的发现为理解其它细胞的信号转导提供了新的线索。
该项工作得到了上海科技大学王皞鹏教授的大力帮助,并得到国家自然科学基金委、中国科学院先导B专项以及科技部的经费支持。该研究工作还得到国家蛋白质科学设施(上海)核磁共振系统,生化与细胞所细胞分析技术平台、分子生物学技术平台的大力支持。
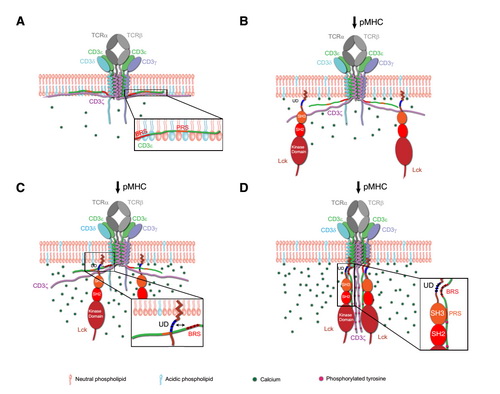
TCR磷酸化起始模型
A. 静息态的T细胞中,CD3e和CD3z链的胞内区通过静电相互作用与细胞质膜内层的酸性磷脂结合,从而将这两个胞内区屏蔽在膜中,其中包括酪氨酸磷酸化位点和负者招募Lck的BRS区。CD3d和g的胞内区虽然暴露在细胞质中,但是由于它们不能独立招募Lck而难以被磷酸化。
B. 抗原(peptide MHC complex,pMHC)结合使得TCR发生形变,引发CD3e和CD3z链的胞内区从膜上解离。
C. CD3eBRS区通过与Lck UD区的静电相互作用来招募Lck。
D. 被招募的Lck磷酸化四条CD3链中的酪氨酸位点,从而激活T细胞中的下游信号通路。