蛋白质上海设施用户在自噬研究方面取得重大科研进展
来源:
时间:2017-09-04
8月24日, 国家蛋白质科学研究(上海)设施质谱系统用户浙江大学基础医学系刘伟教授研究组在Molecular Cell杂志在线发表题为“VPS34 acetylation controls its lipid kinase activity and the initiation of canonical and non-canonical autophagy”的研究论文,发现依赖乙酰转移酶p300的乙酰化修饰在VPS34激活中的关键作用,阐述了这一新机制在启动经典自噬和非经典自噬中的重要意义, 结果提示其对细胞内膜运输的潜在重大影响。
细胞自噬(Autophagy)是真核生物特有的进化上高度保守的依赖于溶酶体的细胞内分解代谢途径,不仅是细胞感知能量缺乏和应激条件的适应性反应,而且参与很多重要的生理过程,在细胞稳态的维持中发挥关键作用。
自噬与组织器官发育、个体衰老、细胞免疫、肿瘤和神经退行性疾病的发生等密切相关。自噬发生需要经过自噬小体的形成、自噬小体与溶酶体的融合和自噬底物在溶酶体降解等过程。自噬小体的形成是自噬发生和完成的关键调控步骤,是当前细胞自噬研究的热点内容。
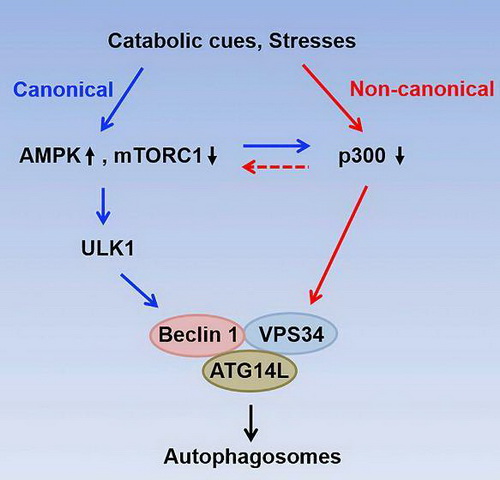
该研究中,研究人员通过基因高表达、基因敲低/敲除、体外乙酰化反应、质谱分析和位点突变等手段发现组蛋白乙酰基转移酶p300能直接乙酰化VPS34,并鉴定出K29、K771和K781是VPS34上的主要乙酰化位点。随后他们通过改变p300活性、制备应用VPS34模拟乙酰化和脱乙酰化突变体,结合免疫荧光实验和一系列体外脂激酶实验发现,乙酰化能抑制VPS34脂激酶活性,K29、K771和K781位点的脱乙酰化对VPS34的激活发挥协同效应,K771位点的脱乙酰化对VPS34的激活起决定作用。
该研究发现并鉴定p300是VPS34的关键乙酰化酶,VPS34的乙酰化修饰对其活性、经典自噬和非经典自噬的启动等至关重要。该研究不仅为进一步研究自噬启动的分子机制、细胞能量营养代谢与细胞内膜运输的关系提供了新思路,还有助于人们深入了解自噬相关人类疾病的发生机理。
上海设施质谱系统彭超博士通过基于质谱技术的蛋白质组学方法帮助用户解析鉴定了p300调控VPS34的乙酰化位点及其动态变化,提供了强有力的专业技术支持,为成果的发表做出了积极贡献。该研究得到国家自然科学基金重点项目和国家重点基础研究发展计划的资助。
p300-VPS34途径参与调控经典和非经典自噬的启动