丛尧研究员受邀在Nature Structural & Molecular Biology发表研究专评
来源:
时间:2017-09-15
9月7日,国际学术期刊Nature Structural & Molecular Biology 发表了中国科学院生物化学与细胞生物学研究所丛尧研究员题为 “Identification of an allosteric network that influences assembly and function of group II chaperonins ” 的专评文章,点评了发表于该期刊的题为“An information theoretic framework reveals a tunable allosteric network in group II chaperonins”的文章。该文章基于他们发展的信息理论框架,发现了Ⅱ型分子伴侣素存在于相邻亚基界面的可调控变构协同网络,并揭示了该网络对于Ⅱ型分子伴侣素的组装及其功能的影响。
Ⅱ型分子伴侣素在ATP驱动下发生构象变化进而协助许多重要蛋白质的正确折叠,是生物体内不可或缺的蛋白质折叠大分子机器,对维持蛋白质稳态起重要作用。Ⅱ型分子伴侣素存在于古细菌以及真核生物中,由两个背对背堆叠的寡聚环组成,每个环都有可以借助内置的盖子而关闭的腔体。古细菌中的Ⅱ型分子伴侣素(Cpn)是同源寡聚物,而真核生物中的
Ⅱ型分子伴侣素TRiC/CCT每个环中含有8个同源但又各不相同的亚基。由ATP水解所驱动的Ⅱ型分子伴侣素的构象变化过程则是由保守的、涉及到环间及环内协同性的变构协同网络所调控,但对该网络及其复杂的变构调节机制仍有待深入研究。
针对这一问题,Stanford大学的Frydman研究团队开发了一种信息理论框架,预测了古细菌Ⅱ型分子伴侣素Cpn的关键变构协同氨基酸网络。有趣的是,他们发现了这个网络中一个关键氨基酸–Met47,它位于与核苷酸结合密切相关的stem-loop上并且处于相邻亚基的界面之上。他们证明Met47在该分子伴侣素的组装及变构调节中发挥了重要作用。如图所示,M47L突变(洋红色)可以提高触发Cpn构象变化的最低核苷酸占据阈值,加强Cpn的变构协调作用及其ATP循环。然而,与野生型相比,M47L突变的Cpn并未显示出增强的底物折叠能力。他们的研究暗示了Ⅱ型分子伴侣素并没有通过进化达到最大程度的协同性及三磷酸腺苷酶活性,但却通过进化使其可以在更为宽泛的核苷酸浓度下达到最优的底物折叠能力。这将确保不同环境和代谢条件下细胞的蛋白质稳态。
发表于Nature Structural & Molecular Biology上的来自丛尧研究员及博士研究生金明梁的这一特邀专评,对分子伴侣素在ATP驱动下进行协同调控进而执行底物折叠功能的机制发表了自己的见解,指出进一步全面了解分子伴侣素协同调控机制的潜在研究方法,并提出了本领域未来需要回答的关键科学问题。
丛尧研究组长期致力于冷冻电镜(cryo-EM)技术图像处理方法及亚基定位方法的发展,并应用冷冻电镜技术在蛋白质质量控制大分子机器TRiC/CCT及蛋白酶体的近原子分辨率结构解析与功能诠释方面取得重要进展(Nat Struc Mol Biol 2016, Cell Research 2017, EMBO J 2012, PNAS 2010),在婴幼儿手足口病致病病毒的抗体和疫苗发展的结构研究方面亦有系列成果(PLoS Pathogens 2016, J Virology 2017)。
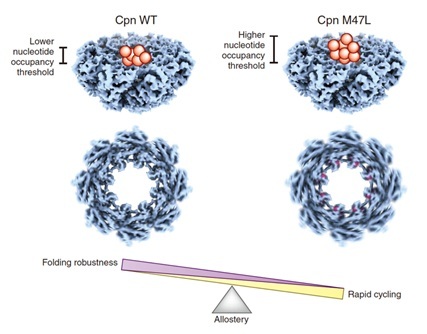
图注:M47L突变对Ⅱ型分子伴侣素Cpn的影响。(红色圆球表示ATP)
