丁建平研究组揭示mTORC1信号通路的重要调控机制
来源:
时间:2017-11-10
11月9日,中国科学院生物化学与细胞生物学研究所丁建平研究组在Nature Communication在线发表了题为“Structural Basis for Ragulator Functioning as a Scaffold in Membrane-anchoring of Rag GTPases and mTORC1”的论文,该工作揭示了Ragulator五元复合物的组装机制和Ragulator复合物调控mTORC1信号通路的分子机制。
真核细胞中mTORC1是一个高度保守的蛋白激酶复合物,它通过感受和整合外界信息,如生长因子、能量状态和营养水平等,调控细胞生长发育和细胞自噬等重要生命过程。mTORC1信号通路的功能失调会引起多种疾病,包括肥胖症、II型糖尿病和肿瘤等。营养物质如氨基酸是mTORC1的重要激活因子。最近研究发现,氨基酸介导的mTORC1信号通路的激活主要在溶酶体上进行,由一系列蛋白质复合物参与这一复杂过程的调控,其中Ragulator五元复合物作为该信号通路的核心骨架,调控Rag小G蛋白和mTORC1在溶酶体上的定位,但是Ragulator复合物如何组装并招募下游蛋白的作用机制还不清晰。
丁建平研究组长期从事mTORC1信号通路调控的分子机制研究,先后测定了mTORC1信号通路中一些重要调控蛋白包括Rheb、TCTP、S6K和Ego3的结构,揭示了它们在mTORC1信号通路中发挥生物学功能的分子基础,近期又完成了酵母TORC1信号通路中Ego1-Ego2-Ego3三元复合物的晶体结构测定和功能分析(Cell Research,2015)、以及mTORC1信号通路上游人源精氨酸感应蛋白CASTOR1-arginine复合物的结构测定和对底物的识别机制(Cell Discovery,2016)。在此基础上,丁建平研究组的副研究员张天龙和博士生王嵘对 mTORC1信号通路开展了进一步研究,测定了Ragulator五元复合物的晶体结构,发现Ragulator复合物中包含MP1-p14和 HBXIP-C7orf59两个亚复合物,并由p18亚基介导两个亚复合物的结合、组装成五元复合物。通过结构分析和功能实验验证,发现Ragulator复合物作为骨架蛋白发挥功能,通过p18的N端结构域和MP1-p14复合物两个结合位点与Rag小G蛋白的Roadblock结构域结合,并在氨基酸等信号因子的激活下进一步招募mTORC1定位在溶酶体上。结构分析和体外活性测定否定了早期认为的Ragulator具有针对Rag小G蛋白的GEF活性,并预测存在尚未鉴定的GEF蛋白与Ragulator复合物结合,共同激活下游Rag小G蛋白。研究人员还发现mTORC1信号通路的抑制因子C17orf59通过竞争性结合Rag 小G蛋白在MP1-p14复合物上的结合位点,抑制Rag 小G蛋白在溶酶体上的定位,从而抑制下游mTORC1活性。通过结构比较发现,人源Ragulator复合物和酵母Ego1-Ego2-Ego3复合物在结构上非常相似, 表明这两个复合物在mTORC1/TORC1信号通路中发挥相似的功能。这些研究结果进一步阐释了氨基酸等营养物质对mTORC1信号通路的调控机制,并且为mTORC1功能异常相关疾病研究和基于mTORC1信号通路的药物设计提供了重要信息。
该项工作得到国家自然科学基金委、中国科学院先导专项和中科院青年创新促进会的经费支持。感谢国家蛋白质科学研究设施(上海)19U1线站和上海光源17U1线站的工作人员在实验数据收集中的支持与帮助。该研究工作还得到蛋白质上海设施复合激光显微成像系统的大力支持。
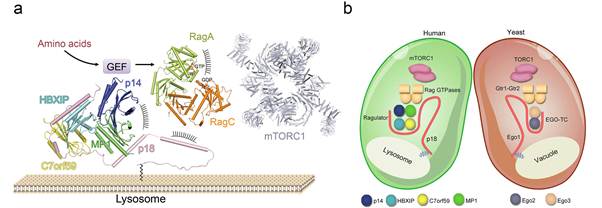
a. Ragulator复合物招募Rag小G蛋白和mTORC1复合物在溶酶体上定位的工作模型;b. 人源Ragulator复合物和酵母Ego1-Ego2-Ego3复合物结构上非常相似, 表明这两个复合物在mTORC1/TORC1信号通路中发挥相似的功能。
