4月26日,国际学术期刊Circulation在线发表了中国科学院生物化学与细胞生物学研究所周斌研究组的研究成果“Genetic Lineage Tracing of Non-myocyte Population by Dual Recombinases”。该研究工作利用新建立的双同源重组技术系统揭示了在胚胎心脏发育、成体心脏稳态维持及损伤修复、成体骨骼肌稳态维持和损伤修复过程中,非肌肉细胞分化形成肌肉细胞的潜能。该研究成果有助于深入了解不同器官,或同一器官的不同发育阶段,非肌肉细胞的转分化作用,为肌肉的再生医学研究提供新的思路。此外该技术并没有依赖特定的干细胞分子标记去研究组织中是否存在干细胞向功能细胞(如肌肉细胞)分化过程。
心脏作为脊椎动物最重要的器官之一,主要功能是为血液流动提供动力。心脏发生心肌梗塞后造成心肌细胞大量死亡,心脏功能受到影响。成体心脏是否存在心肌干细胞一直存在争论,之前的研究利用传统的遗传谱系示踪技术认为在成体心脏中存在心肌干细胞,例如Kit+心肌干细胞,Bmi1+心肌干细胞,Scal1+心肌干细胞,Islet+心肌干细胞等,但由于这些心肌干细胞的分子标记本身就表达于部分心肌细胞中,因此这些假设的心肌干细胞向心肌细胞的分化潜能受到质疑。
在本项研究中,研究人员利用双同源重组技术同时对肌肉细胞和非肌肉细胞进行谱系示踪,系统揭示非肌肉细胞向肌肉细胞分化的潜能。在胚胎心脏发育早期,Isl1+的心肌干细胞可以贡献第二心区的心肌细胞,例如,心脏的流出道,右心室部分的心肌细胞,以及左心室和心房非常少量的心肌细胞均来自于Isl1+的心肌干细胞。研究人员利用双同源重组技术特异性地对胚胎早期的非心肌细胞进行遗传谱系示踪发现,在胚胎心脏发育早期,非心肌细胞具有分化形成心肌细胞的能力,这些非心肌细胞可以贡献形成第二心区的心肌细胞。在成体心脏的稳态维持过程中,研究人员利用双同源重组技术对非肌肉细胞和肌肉细胞同时谱系示踪发现,非肌肉细胞和肌肉细胞维持各自的细胞命运,非肌肉细胞不会转分化形成肌肉细胞,而在成体心脏发生心肌梗塞后,造成心肌细胞大量死亡,心脏功能受损,但心脏中肌肉细胞和非肌肉细胞依然维持各自的细胞命运,非肌肉细胞不会转分化形成肌肉细胞来弥补死亡的肌肉细胞,即成体心脏在稳态维持和损伤修复过程中都不会发生非肌肉细胞向肌肉细胞的转分化。骨骼肌在稳态维持过程中,肌纤维细胞与非肌肉细胞发生融合,肌纤维细胞处于多核状态,而当对骨骼肌实施BaCl2损伤后,骨骼肌中肌纤维细胞大量死亡,但在骨骼肌的损伤修复过程中,研究人员发现骨骼肌中的非肌肉细胞可以转分化形成肌纤维细胞,促进骨骼肌的损伤修复。以上研究成果将为肌肉的再生医学提供理论基础。
该研究工作是由博士生李燕,副研究员何灵娟等在周斌研究员的指导下完成。该研究工作得到香港中文大学吕爱兰教授等的大力支持,同时得到中国科学院、国家基金委、科技部、上海市科委等资助。
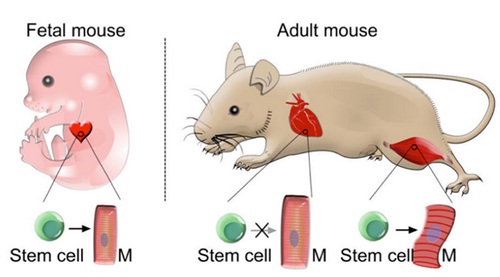
非肌肉细胞向肌肉细胞转分化的潜能