王恩多研究组在哺乳动物细胞中发现一种新的氨基酰-tRNA合成酶基因
来源:
时间:2018-05-04
3月20日,国际学术期刊Nucleic Acids Research在线发表了中国科学院生物化学与细胞生物学研究所王恩多研究组题为“A threonyl-tRNA synthetase-like protein has tRNA aminoacylation and editing activities”的最新研究成果。
氨基酰-tRNA合成酶 (aaRS) 是一类看家酶,催化tRNA氨基酰化反应,生成氨基酰-tRNA参与蛋白质合成,是维持生命活动必不可少的酶。随着生物的进化,高等真核生物aaRS还参与一系列翻译过程之外的功能,例如血管发育、肿瘤发生、免疫应答、发育过程和基因表达调控等,统称为aaRS的非经典功能,对于维持生命体稳态同样具有重要意义。这些功能通常是由aaRS末端独特的延伸结构域通过蛋白质-蛋白质相互作用介导完成。
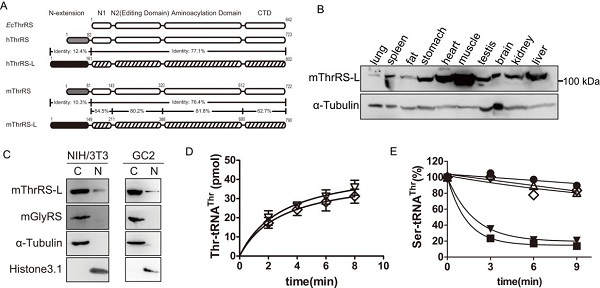
人核基因组中共有37个aaRS基因,负责编码细胞质和线粒体两套蛋白质合成系统所需的aaRS。对于某一种氨基酸而言,一般只有两个aaRS基因与之对应,分别编码细胞质和线粒体aaRS。有趣的是,2013年,王恩多组首次发现,在高等真核生物中,除了TARS和TARS2基因分别编码细胞质和线粒体苏氨酰-tRNA合成酶 (ThrRS) 以外,还存在第三种基因TARSL2,编码一个与细胞质ThrRS高度类似的蛋白质 (命名为ThrRS-like, ThrRS-L)。ThrRS-L与ThrRS主体结构序列保守性较高,但N-末端进化出截然不同的延伸结构域。进化分析表明,TARSL2是来源于TARS的基因重复 (Zhou et al., Nucleic Acids Res., 2013, 41, 302-314)。这是迄今在人细胞中发现的第一例aaRS重复基因。ThrRS-L具有相对保守的合成和编校结构域,它是否具有经典的蛋白质合成功能是尚未解决的科学问题;此外,TARSL2只在高等真核生物中出现,且具有独特的N-末端延伸结构域,暗示ThrRS-L可能通过与某些蛋白质相互作用行使氨基酰化外的非经典功能。
在王恩多研究员和周小龙研究员的共同指导下,博士研究生陈云等通过体内体外实验研究了小鼠Tarsl2 (人TARSL2同源基因) 基因在小鼠体内的表达模式、蛋白质的细胞定位及ThrRS-L介导的产生Thr-tRNAThr的合成功能和水解误氨基酰化产物Ser-tRNAThr的编校功能。实验结果表明,Tarsl2基因在小鼠组织中普遍表达,但具有组织特异性,在肌肉和心脏中含量最高,暗示其在心脏和肌肉发育及运转过程中发挥作用;此外,与小鼠胞质ThrRS (mThrRS,Tars编码) 的细胞质定位不同,Tarsl2编码的蛋白质 (mThrRS-L) 在细胞质与细胞核中均有分布,由C-末端核定位信号介导细胞核定位,暗示它在细胞核内发挥某种特定功能。通过体外酶学动力学研究发现,mThrRS-L具有与mThrRS相似的合成和编校活性,但编校错误产物能力明显降低以及跨物种交叉识别tRNA的能力存在差异,表明在经典功能方面,两者存在差别。
以上研究首次揭示哺乳动物中特有的重复基因编码的aaRS的经典功能;也揭示了小鼠Tarsl2的表达与分布特性,为进一步深入揭示其可能介导的非经典功能奠定基础。
该工作得到中科院、科技部、基金委、上海市科委等项目资助。
小鼠的表达、细胞质定位及活性
