周斌研究组建立器官特异性血管遗传靶向技术
来源:
时间:2018-05-18
血管是血液流通的管道,负责运输氧气、营养物质以及代谢废物,在器官和组织的发育及再生过程中起到至关重要的作用。不同器官的血管在结构及功能上是异质性的。在组织损伤反应过程中,血管内皮细胞协调组织特异性干细胞自我更新和分化以促进组织修复,并分泌大量趋化因子和分泌因子诱导组织再生。不同器官的内皮细胞在损伤反应中的作用都是独特的。研究血管常用的遗传工具小鼠为
VE-cad-Cre、
Tie2-Cre等,这些工具小鼠标记所有的内皮细胞,无法精确地研究特定组织器官的血管。因此提高遗传靶向的精度,开发组织特异性Cre工具将促进研究人员对内皮细胞在器官形成及再生过程中的深入功能研究。
到目前为止,遗传靶向工具主要依赖于Cre-LoxP同源重组系统以解决细胞示踪问题,进行基因功能研究。该系统的精度在很大程度上取决于基因表达的特异性,这种传统方法具有固有的局限性。在本项研究中,研究人员利用两套互相排他的同源重组系统即Dre-Rox与Cre-LoxP系统进行顺序交叉遗传靶向操纵,实现精确地遗传靶向器官特异性的血管。顺序交叉遗传靶向操纵系统包括两个要素:A-Dre和B-Cre-Rox-ER-Rox。传统的CreER位于细胞质中,无法入核进行Cre-LoxP反应。在同时表达A和B的细胞中,Dre重组酶将识别并切割Rox位点,之后B-Cre将从细胞质中释放入核,进行后续的Cre-LoxP反应。至此研究人员利用两个启动子更加精确地限定了标记的细胞,并且最后的有效输出是Cre重组酶。该项工作为组织特异性基因操作提供了一个有效的策略,可以广泛地应用到其他生物医学领域。
该项工作在周斌研究员的指导下,由研究生蒲文娟等完成,并得到军事医学科学院杨晓研究员、英国牛津大学Nicola Smart教授等大力支持。研究工作得到中国科学院、国家基金委、上海市科委等资助。
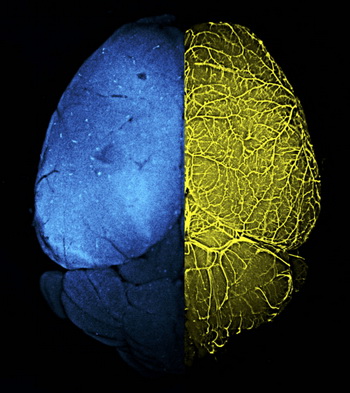
左侧:血脑屏障传统遗传靶向工具小鼠Mfsd2a-CreER; R26-tdTomato标记大脑细胞荧光图
右侧:器官特异性遗传靶向工具小鼠BEC-Cre更加精准地标记大脑血管内皮细胞
