陈剑峰研究组发现趋化因子介导的整合素α4β7配体特异性识别的结构基础
来源:
时间:2018-05-28
5月22日,国际知名学术期刊
The Journal of Cell Biology在线发表了中国科学院生物化学与细胞生物学研究所陈剑峰研究组的研究论文“Integrin α4β7 switches its ligand specificity via distinct conformer-specific activation”。该研究发现不同趋化因子CCL25、CXCL10和金属离子锰可以分别刺激整合素α4β7使其稳定在不同活化构象,从而调控其对配体MAdCAM-1和VCAM-1的差异性结合,
参与精准地调控淋巴细胞的组织特异性归巢。
淋巴细胞在体内的组织特异性迁移是受到精准调控的,这主要依赖于淋巴细胞表面的整合素与表达在不同组织中的配体之间的特异性黏附。有趣地是,表达在淋巴细胞表面的整合素通常可以与多种配体蛋白结合。整合素α4β7可同时识别MAdCAM-1和VCAM-1两种配体。其中MAdCAM-1主要表达在肠道,负责介导淋巴细胞定向迁移至肠道组织;VCAM-1主要表达在炎症部位的血管内皮表面、外周淋巴结以及骨髓。该团队前期工作表明
两类趋化因子通过激活不同的下游信号通路导致整合素胞内调节蛋白talin和kindlin-3与整合素α4β7胞内结构域的不同结合模式,并通过inside-out信号引起整合素α4β7的不同活化。不同活化形式的整合素α4β7会选择性地识别MAdCAM-1和VCAM-1,调控淋巴细胞向不同组织归巢(
Developmental Cell 2014)。但不同趋化因子所活化的整合素α4β7为什么可以选择性结合不同配体的分子机制未知。
在陈剑峰研究员与美国理海大学张晓辉研究员以及中科院
大连化学物理研究所李国辉研究员的共同指导下,博士研究生王诗慧等人发现相较锰离子引起的整合素α4β7的高度伸展的活化状态,CCL25和CXCL10可以诱导整合素α4β7产生两种截然不同的中间态活化构象。相对于CXCL10刺激而言,CCL25会诱导α4β7产生一个更加伸展的活化构象。这两种中间态活化构象整合素α4β7通过识别MAdCAM-1或VCAM-1的第二个Ig结构域而表现出对两种配体相反的选择性。而被锰离子活化的α4β7处于高度活化的伸展构象,对于两种配体具有同样的高亲和性,无法区分两种配体。该工作首次在单分子水平证实活细胞表面整合素在不同的生理刺激下可以被差异性活化并稳定在不同的中间态活化构象。更为重要的是,这些不同的
中间态活化构象和完全活化构象具有截然不同的生物学功能,从而可以精细调控免疫细胞在体内运动的组织特异性。
该项研究获得国家自然科学基金、国家基础研究计划、中科院/国家外国专家局国际合作项目等的经费资助。
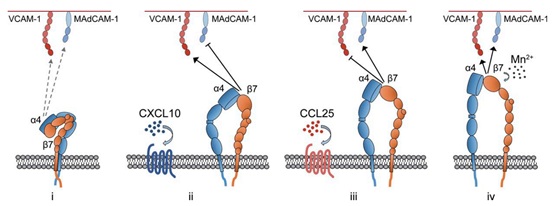
趋化因子和金属离子Mn2+引起的不同活化构象的整合素α4β7特异性识别不同配体示意图
