胡红雨研究组揭示多聚谷氨酰胺延伸蛋白募集泛素受体蛋白质的分子机制
来源:
时间:2018-06-06
5月30日,国际学术期刊The FASEB Journal发表了中国科学院生物化学与细胞生物学研究所胡红雨研究组的研究论文“PolyQ-expanded huntingtin and ataxin-3 sequester ubiquitin adaptors hHR23B and UBQLN2 into aggregates via conjugated ubiquitin”。该研究发现多聚谷氨酰胺延伸蛋白可以通过其自身的泛素化修饰募集细胞中与泛素相互作用的蛋白质,导致被募集的泛素受体蛋白的功能受损而引发细胞毒性。研究成果支持了课题组之前提出的挟持模型(Hijacking Model),即蛋白质积聚募集与之相互作用的生物大分子(蛋白质和RNA)是导致神经退行性疾病中出现生物分子功能丧失和细胞毒性的一个重要原因。
神经退行性疾病是一类与蛋白质错误折叠和积聚密切相关的疾病,主要包括阿尔兹海默病、帕金森病和多聚谷氨酰胺延伸类疾病。多聚谷氨酰胺(PolyQ)延伸类疾病 (简称PolyQ疾病),是由特定基因的CAG三核苷酸重复序列延伸所引起的疾病,最常见的包括亨廷顿舞蹈症和脊髓小脑共济失调症3型。虽然此类疾病的致病蛋白质各不相同,但它们一个显著的共同特点是在特定神经元中形成不可溶的积聚物或包涵体。除了致病蛋白质,包涵体中还有很多其它生物分子,如泛素-蛋白酶体系统组分、自噬受体蛋白、分子伴侣和转录因子等。有趣的是,对于不同的神经退行性疾病相关的包涵体,其中有些成份是独特的,而有些成份却是一样的,像泛素、蛋白酶体组分、泛素受体蛋白hHR23B及UBQLN2及P97/VCP等。然而,为什么不同的神经退行性疾病相关蛋白质形成的包涵体中都含有泛素及泛素相关组份还是未知的。
PolyQ疾病是单基因突变引起的疾病,是用来研究神经退行性疾病致病机制的分子模型。杨慧博士和博士生岳宏伟等以PolyQ延伸蛋白Huntingtin (Htt) 和Ataxin-3 (Atx3)为对象研究了PolyQ延伸蛋白质募集细胞中泛素受体蛋白hHR23B和UBQLN2的分子机制及细胞效应。他们发现PolyQ延伸的Htt和Atx3可特异地将细胞中内源的泛素受体蛋白hHR23B和UBQLN2募集到不可溶的积聚物或包涵体中,这种特异性的募集作用依赖于泛素受体蛋白hHR23B和UBQLN2中负责与泛素相互作用的泛素结合结构域;进一步研究表明PolyQ延伸蛋白自身的泛素化对于该募集作用至关重要。他们还发现细胞中PolyQ延伸的Htt和Atx3可以通过募集hHR23B而降低在DNA修复中起重要作用的XPC蛋白的量,表明该募集作用可能通过使hHR23B功能受损而引发细胞毒性。该研究工作不仅阐明了PolyQ延伸蛋白募集泛素受体蛋白及形成含有泛素包涵体的分子机制,也让研究人员更进一步了解了PolyQ疾病和其它神经退行性疾病的致病分子机制。
该项研究工作得到了国家科技部、基金委、中国科学院的经费及中国博士后科学基金的支持。
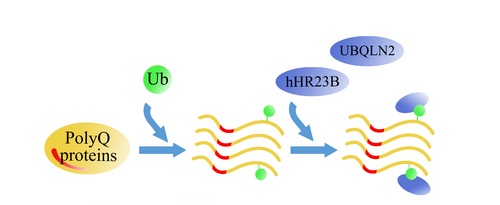
PolyQ延伸的蛋白质(黄色)被泛素化(绿色)修饰,形成的积聚物或包涵体可以通过修饰上去的泛素将细胞中的泛素受体蛋白hHR23B和UBQLN2等募集到不可溶积聚物或包涵体中,从而导致被募集蛋白的功能受损。
