当造血干细胞遭遇青春期——周波研究组合作发现促黄体生成素调节造血干细胞稳态
来源:
时间:2018-07-25
7月23日,The EMBO Journal在线发表了中国科学院生物化学与细胞生物学研究所周波研究组和上海交通大学郑俊克研究组合作的题为“Luteinizing hormone signaling restricts hematopoietic stem cell expansion during puberty” 的最新研究成果。该工作首次揭示一种青春期起始分泌的脑垂体激素——促黄体生成素(Luteinizing hormone,LH)在造血干细胞(HSC)稳态维持中的重要调控功能。
与肿瘤细胞一样,干细胞在体内具有无限增殖的潜力;但与肿瘤细胞不同的是,各个组织的成体干细胞数量处于严密的调控状态,这被称之为成体干细胞的计量机制(Counting Mechanism)。这种计量机制已经在多种成体干细胞中得到证实,然而,直至目前,机体实现这种计量机制的分子基础仍然讳莫如深,计量机制的生物学意义更是无从知晓。如果机体拥有更多的成体干细胞,是更健康还是不健康?
HSC是一类能够自我更新并具有分化成所有造血谱系细胞潜能的成体干细胞。在不同的发育阶段,HSC的功能受到严密调控,许多通路以细胞自主性的方式参与了这一调控过程。而近年来的研究发现,外源因子在HSC稳态维持中同样起着至关重要的作用。HSC微环境内的间充质干细胞、内皮细胞能够分泌包括SCF和CXCL12在内的多种细胞因子调控HSC稳态。这些研究结果拓展了这一领域的关键基础问题——是否还存在其它外源因素调控HSC功能?
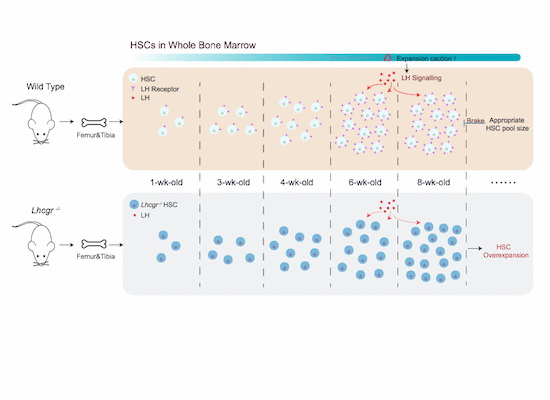
不同于造血微环境内SCF、CXCL12信号,促黄体生成素并非来源于HSC附近的“近水楼台”。这一系统性激素由远端的脑垂体分泌。作为性激素的上游分子,促黄体生成素的“本职工作”是参与调控雌雄生殖系统的成熟。 而周波/郑俊克组的工作则阐述了促黄体生成素的另一全新功能——调节青春期小鼠骨髓HSC稳态。他们的研究显示,出生后,小鼠骨髓内HSC进入高速扩增期,而伴随着小鼠青春期的起始,这一发育进程驶入了“刹车制动”阶段,HSC的数量开始逐步达到稳定。在这一阶段内,骨髓HSC表面促黄体生成素受体(Luteinizing hormone receptor, Lhcgr)的表达量也呈现了显著性增长。通过免疫荧光、流式细胞分析等多种实验手段,他们进一步发现促黄体生成素受体直接表达于HSC,且在HSC群内高度富集。基于这些早期发现,他们利用Lhcgr敲除小鼠模型进行了下游相关表型分析,实验结果显示,LH信号的阻断将导致成年小鼠骨髓内HSC过度扩增,外周血白细胞异常增多。这一证据直接证明LH信号在调控HSC功能过程中发挥着关键作用。此外,他们还在MLL-AF9诱导的急性髓系白血病模型中发现Lhcgr敲除将加速白血病发病速度。
在早期的研究报道中,科学家已经发现了包括雌雄激素在内的多种性激素能够调节造血系统稳态。然而,后续的研究结果显示,骨髓HSC并不表达孕激素或雄性激素受体,同时雌激素受体Esr1的敲除对HSC的自我更新并没有产生直接影响。这些结果提示以往发现的性激素对HSC的调控功能仅仅只是一种间接作用。而在周波及其合作课题组的工作中,他们不仅利用Lhcgr敲除小鼠直接验证了LH信号的调控作用,还基于性腺摘除、HSC移植等方法证明了LH信号的调控功能既不依赖于下游性激素,也非通过作用于干细胞微环境进行,完整地论证了LH信号通过HSC这一直接靶标发挥相应的调控作用。
总之,周波/郑俊克课题组的这项工作首次提出了一种HSC的计量机制——脑垂体通过分泌LH让HSC的数量在青春期实现稳态。一旦HSC的LH信号感应受阻,骨髓内HSC会在青春期继续扩增,最终导致骨髓过度造血和白细胞增多症(Leukocytosis),于此相伴随的是,白血病进程的加速。因此,本文也首次揭示了干细胞计量机制生理学意义:维持正常造血和抑制白血病进展。
硕士二年级学生彭义是本文的第一作者,喻华和郝晓鑫是本文的共同第一作者。周波、郑俊克研究员是本项工作的共同通讯作者。该工作得到了中国科学院战略先导项目、科技部干细胞及转化研究重点研究计划和国家自然科学基金委的经费支持。