陈江野研究组揭示NuA4 与SWR1复合物的整合和分离调控细胞命运可塑性的机制
来源:
时间:2018-08-24
8月14日,国际学术期刊Cell Discovery在线发表了中国科学院生物化学与细胞生物学研究所陈江野研究组的科研成果“Merge and separation of NuA4 and SWR1 complexes control cell fate plasticity in Candida albicans”。该研究揭示了组蛋白乙酰转移酶复合物NuA4与染色质重塑复合物SWR1的整合和分离在白念珠菌形态转换过程中的调控机制,推测NuA4 与SWR1复合物的融合在真核生物进化过程中具有重要意义。
白念珠菌是一种人类机会性致病真菌,以多种形态寄生于人体,包括酵母态和菌丝态,其形态转换能力与其致病能力直接相关。酵母-菌丝形态的转变受多种外界刺激影响,同时受细胞内多种转录因子和染色质修饰复合物调控。组蛋白乙酰转移酶复合物NuA4和染色质重塑复合物SWR1是真核细胞中进化保守的复合物。以前的研究表明,在低等真核生物比如酿酒酵母中,NuA4和SWR1是两个独立存在却又协同作用的复合物;而在高等真核生物比如人类中,NuA4和SWR1融合成一个大的复合物称之为TIP60,TIP60同时拥有NuA4复合物的成员和SWR1复合物的成员。
在本项研究工作中,研究人员发现在酵母态白念珠菌细胞中,NuA4和SWR1复合物能融合形成一个大的复合物,与人的TIP60相类似,而在菌丝态细胞中,NuA4和SWR1分成两个独立的复合物,与酿酒酵母的复合物相似。NuA4和SWR1复合物的融合是通过NuA4复合物的平台蛋白Eaf1锚定于SWR1复合物上的Yaf9来实现的,NuA4复合物的核心酶Esa1能介导Eaf1 K173的乙酰化,从而被Yaf9的YEATS结构域所识别,进而桥接了两个复合物。而在菌丝发育过程,菌丝特异性转录因子Brg1能招募去乙酰化酶Hda1,从而去除了Eaf1 K173的乙酰化,直接导致两个复合物的分离。该研究首次证明NuA4与SWR1复合物动态的离合直接调控白念珠菌酵母-菌丝形态转换的基因表达,揭示NuA4 与SWR1复合物的整合和分离在细胞命运可塑性调控中的一种新机制。
该研究工作在陈江野研究员的指导下,由王雄军博士和研究生朱文成等人完成,得到了加州大学欧文分校刘浩平教授的大力支持,同时得到中国科学院和国家自然科学基金委的经费支持。
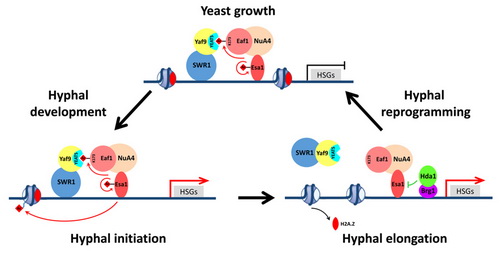
NuA4和SWR1复合物的动态离合调控白念珠菌的酵母-菌丝形态转换
