李劲松和陈勇研究组合作利用“人造精子”技术首次实现蛋白质重要氨基酸的个体水平遗传筛选
来源:
时间:2018-10-08
10月1日,国际知名学术期刊Nature Cell Biology 在线发表了中国科学院生物化学与细胞生物学研究所李劲松和陈勇研究组的最新合作研究成果“CRISPR–Cas9-mediated base-editing screening in mice identifies DND1 amino acids that are critical for primordial germ cell development”。该工作利用最新的CRISPR/Cas9介导的单碱基编辑系统 (BE3) 结合单倍体胚胎干细胞(“人造精子”)介导的半克隆技术,对影响小鼠原始生殖细胞(PGCs)发育的重要基因Dnd1实现个体水平氨基酸功能位点的遗传筛选。
CRISPR/Cas9基因编辑系统利用Cas9核酸内切酶结合sgRNA对靶DNA进行切割,诱发DNA进行非同源末端连接(Non-homologous End Joining,NHEJ)或同源重组(Homology-directed repair,HDR)损伤修复机制,进而实现靶基因序列突变。2016年,David R. Liu课题组建立了基于CRISPR/Cas9技术的高效诱导单一核苷酸突变的胞嘧啶单碱基编辑器(BE3),通过nickase Cas9蛋白(nCas9)上偶联大鼠胞嘧啶脱氨酶(rAPOBEC1),可以将靶位点C•G转变为T•A(Komor et al., 2016, Nature)。由于该系统避免了传统CRISPR/Cas9导致DNA双链断裂可能带来的损伤,迅速被国内外科学家应用于不同物种的基因编辑。单碱基编辑系统除可以进行单个氨基酸位点的基因编辑以外,理论上还可以通过氨基酸位点的遗传筛选进行蛋白结构和功能的在体研究,不过该应用至今未见报道。
李劲松研究组长期从事小鼠孤雄单倍体胚胎干细胞及其应用的研究。2012年,李劲松研究组与徐国良研究组合作首次建立了孤雄单倍体胚胎干细胞,并证明这些细胞能够代替精子使卵母细胞“受精”产生半克隆小鼠,不过该技术产生半克隆小鼠的效率低下(Yang et al., 2012, Cell)。2015年,李劲松研究组和杨力研究组合作,通过删除两个印记调控区域(Differentially Methylated Region, DMR), H19-DMR和IG-DMR,获得了能够高效产生半克隆小鼠出的孤雄单倍体胚胎干细胞(“人造精子”)(Zhong et al., 2015, Cell stem cell)。因此他们推测,“人造精子”介导的半克隆技术与BE3技术结合,有可能实现特定蛋白质关键氨基酸的在体遗传筛选。
为此,研究人员首先在小鼠胚胎干细胞系中,通过碱基编辑器(BE3)的N端和C端同时加上一个核定位序列,建立了高效的单碱基编辑系统。之后,他们将该系统应用于小鼠“人造精子”上,发现优化的BE3不仅可以在“人造精子”上实现高效的单碱基编辑,将携带BE3的“人造精子”注入卵子还可以高效地产生纯合点突变的半克隆小鼠。紧接着他们向“人造精子”中导入了一个靶向Dnd1基因的一个sgRNA慢病毒文库(含77个sgRNA),发现能在半克隆小鼠中高效地诱导不同位点的单碱基突变。通过两轮的遗传筛选,他们发现并验证DND1的E59K、V60M、P76L和G82R对PGCs的发育具有重要作用。紧接着他们通过蛋白结构的预测、突变后蛋白的稳定性、蛋白与蛋白相互作用等多个层次分析发现这些位点对于DND1蛋白质稳定性和其与其它蛋白质相互作用起着关键的作用。
该工作在国际上首次利用碱基编辑技术实现了个体水平蛋白质关键氨基酸功能位点的遗传筛选,为蛋白质结构和功能的研究开辟了一个新的体系。该体系的另一潜在的重要应用是筛选的人类疾病相关基因的功能位点,并与已有的SNVs数据库进行比对,预测疾病相关基因的致病位点。
该工作在李劲松和陈勇研究员的共同指导下,由李劲松组博士生李庆和陈勇组博士后黎彦璟等完成。该工作得到了国家科技部、国家基金委、中国科学院B类先导专项、以及上海市科委经费的支持,并得到了生化与细胞研究所GTP(全基因组标签计划)中心和动物实验技术平台的支持。
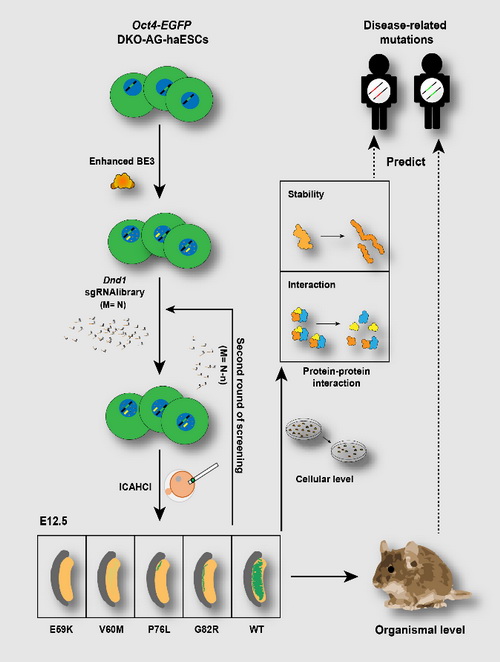
“人造精子”结合碱基编辑技术实现蛋白质重要氨基酸的在体遗传筛选
