陈勇研究组合作揭示酵母染色体端粒粘附到细胞核内膜上的调控机制
来源:
时间:2018-11-30
11月20日和29日,国际学术期刊Nucleic Acid Research和Structure分别在线发表了中国科学院生物化学与细胞生物学研究所陈勇研究组题为“Structural insights into chromosome attachment to the nuclear envelope by an inner nuclear membrane protein Bqt4 in fission yeast ”和“The inner nuclear membrane protein Bqt4 in fission yeast contains a DNA-binding domain essential for telomere association with the nuclear envelope ”的研究论文,两篇论文系统揭示了Bqt4在端粒-核膜连接中发挥功能的分子机制。
真核细胞染色质通常会区域性地定位于细胞核内膜周围,这一现象在高等生物细胞中普遍存在。染色质与核内膜的粘连是受到动态调控的,如体细胞有丝分裂间期染色质末端(端粒)会被招募到细胞核内膜上,进入有丝分裂期端粒又会从细胞核内膜上解离下来。这一周期性的端粒-核膜连接对染色质稳态的维持以及细胞分裂至关重要。在裂殖酵母细胞中,端粒与细胞核内膜的连接通过端粒蛋白Rap1和核内膜蛋白Bqt4来完成。然而其具体的相互作用模式以及细胞周期性调控机制并不是很清楚。
在发表于Nucleic Acids Research的工作中,研究人员首先确定核内膜蛋白Bqt4通过其NTD(N-terminal domain)和端粒蛋白Rap1的BBM(Bqt4-Binding-Motif)相互作用,并解析了Bqt4NTD-Rap1BBM复合物的晶体结构。结构分析发现端粒蛋白Rap1的BBM形成一股α-螺旋坐落于核膜蛋白Bqt4NTD由三股β-折叠形成的口袋当中。酵母体内实验发现突变两者相互作用的重要氨基酸时,裂殖酵母的端粒不再被招募到细胞核内膜上,同时会导致减数分裂障碍以及畸形孢子的产生。结构模型和生化分析显示端粒蛋白Rap1 BBM的N端和C端两个丝氨酸可以被不同的激酶磷酸化,从而分别增强和减弱Bqt4-Rap1之间的相互作用。这揭示了端粒被招募到细胞核内膜上的动态调控机制。此外,研究人员还发现,Bqt4 NTD可以作为一种骨架蛋白以相同的口袋来结合多种蛋白,包括核内膜蛋白Lem2和Sad1等,并解析了Bqt4NTD-Lem2BBM和Bqt4NTD-Sad1BBM的复合物晶体结构。此前有研究报道Lem2和Sad1对异染色质维持以及减数分裂的重要性,因此,这项工作也扩展了人们对核膜蛋白Bqt4功能的理解。
在发表于Structure的工作中,研究人员同时发现Bqt4 NTD非常类似一种名为APSES的DNA结合结构域,并且通过生化实验确定Bqt4具有双链DNA结合能力。酵母体内实验结果显示,当突变与DNA相互作用的关键氨基酸时,会导致端粒从核膜上解离下来。同时发现,Bqt4 NTD结合DNA与结合端粒蛋白Rap1的结合面有一定的重叠,竞争性实验表明DNA和Rap1是竞争性结合Bqt4 NTD的。综合所有数据,该项工作认为Bqt4 NTD结合DNA首先在“宏观”上拉近染色质与核内膜的距离,从而促使端粒蛋白更容易接触到到核膜上的Bqt4。因此Bqt4 NT的DNA结合能力是诱导了端粒被招募到细胞核内膜上的初始(Priming)过程。
该两项工作均与日本大阪大学的Junko Kanoh研究团队合作完成。陈勇组胡纯一博士、日本大阪大学的Haruna Inoue博士、陈勇组博士研究生孙文琦为本文的共同第一作者,陈勇研究员和Junko Kanoh教授为论文的共同通讯作者。该研究工作得到了中科院、基金委、科技部以及上海市科委等经费支持。同时国家蛋白质科学研究设施(上海)线站工作人员在晶体衍射数据收集中给予了支持与帮助。
文章链接:
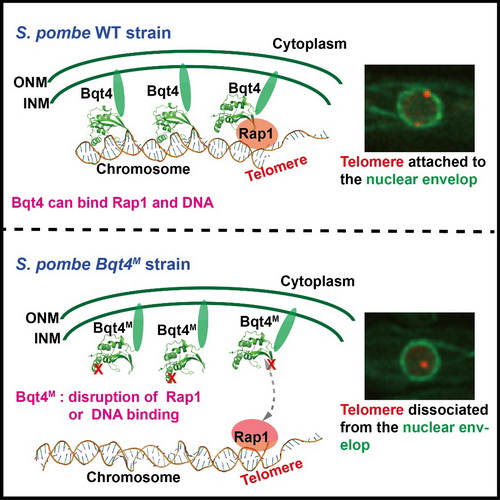
酵母内膜蛋白Bqt4参与端粒和核膜连接的分子模型。Bqt4丧失Rap1蛋白或者DNA结合能力后,导致端粒从核膜上解离。
