丛尧研究组揭示酵母组蛋白甲基转移酶COMPASS复合体的完整结构
来源:
时间:2018-12-07
11月27日,国际学术期刊
Scientific Reports在线发表了中国科学院生物化学与细胞生物学研究所丛尧研究组的最新成果
“Architecture and subunit arrangement of the complete
Saccharomyces cerevisiae COMPASS complex”。该工作首次解析了完整的酵母组蛋白甲基转移酶COMPASS复合体的冷冻电镜结构,揭示了其亚基排布方式,为进一步研究COMPASS复合体催化组蛋白H3K4甲基化的机制提供了结构基础。
组蛋白H3第四位赖氨酸(H3K4)的甲基化在DNA转录、修复等过程中起重要作用,酵母中该过程由组蛋白甲基转移酶COMPASS复合体催化完成。该复合体从酵母到人高度保守。存在六种人源COMPASS复合体(MLL1-4/COMPASS, SET1A/COMPASS和SET1B/COMPASS),其亚基或功能的缺失或突变将引起白血病、肿瘤等诸多人类疾病。该类复合体组成复杂且极具动态性和构象不均一性,给结构生物学研究带来极大挑战,至今尚无完整结构。
丛尧研究员指导助理研究员王艳兴及博士后丁占玉等实验室成员,在酵母细胞中超表达了包括全部7个亚基的COMPASS复合体,并首次解析了完整COMPASS复合体的冷冻电镜结构。综合应用该实验室自行发展的复合体亚基中位标签定位方法YISEL及YISPANL(JMB,2018;Sci Rep, 2018)联合冷冻电镜结构解析,并结合交联质谱(XL-MS)测定(由黄超兰研究员、黄敏工程师完成),确定了COMPASS复合体的亚基排布方式及其作用网络。该研究提出了COMPASS复合体结合底物核小体催化H3K4甲基化的潜在分子机制,并为研究相关人源COMPASS复合体的完整结构及功能奠定基础。
该研究得到大阪大学Junichi Takagi教授,生化与细胞所周金秋、周兆才和陈勇研究员,上海交通大学黄晶和雷鸣教授,以及中科院生物物理所许瑞明研究员的大力支持;同时得到国家蛋白质科学研究(上海)设施冷冻电镜系统、数据库与计算分析系统、质谱系统及规模化蛋白质制备系统的设备支持。该研究获国家自然科学基金委、国家科技部及中国科学院资助。
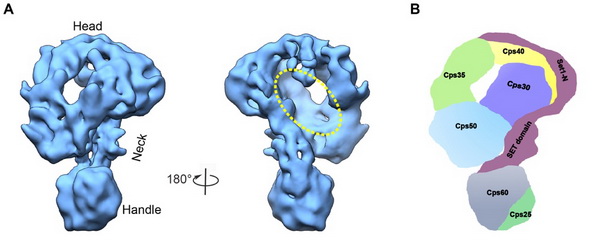
完整酵母COMPASS复合体的结构研究。(A)COMPASS复合体冷冻电镜三维结构;(B)COMPASS各亚基排布示意图
