12月12日,国际学术期刊Nucleic Acids Research在线发表了中国科学院生物化学与细胞生物学研究所王恩多研究组的最新研究成果:“Archaeal NSun6 catalyzes m5C72 modification on a wide-range of specific tRNAs”。
m5C72是近期发现的位于人胞质tRNAThr和tRNACys接收茎的修饰,由人NSun6 (hNSun6)负责催化完成。该研究组前期工作揭示了hNSun6识别tRNA的关键元件和其催化机理(Long, T, et al, 2016, JBC; Liu, RJ and Long, T, et al, 2017, NAR)。有趣的是hNSun6的同源物仅存在于高等真核生物和超嗜热古细菌中。与已广泛鉴定的真核生物NSun6基因(nsun6)相比,古细菌中相应的nsun6基因有待鉴定。在古细菌Pyrococcus horikoshii OT3中,PH1991是hNSun6的同源物。与hNSun6相比,PH1991虽然含有催化中心的保守氨基酸残基,但其可能参与RNA结合的残基具有明显的差异。目前,PH1991的RNA底物和功能仍未知。
在王恩多和刘如娟研究员共同指导下,博士研究生李静等人揭示了PH1991确实是P. horikoshii tRNA:m5C72修饰酶(PhNSun6),并鉴定了它的tRNA底物。结合生物化学和结构生物学研究阐明了PhNSun6具有比hNSun6更广泛的tRNA底物,这是由于PhNSun6识别tRNA底物的以下特点:1. PhNSun6上的73位核苷酸结合口袋可以专一地容纳U73或G73的PhtRNA,而不像hNSun6该口袋只能容纳U73;2. PhNSun6缺少真核生物NSun6特殊的富赖氨酸线圈结构,使它不识别tRNA的D茎区域。PhtRNA的m5C72不影响PhNSun6氨基酰化活力,却可以略微升高PhtRNA的热稳定性。结合之前hNSun6的工作,研究人员提出了高等真核生物和超嗜热古细菌NSun6的进化模型。
该工作得到了国家科技部、基金委、中科院的项目资助。
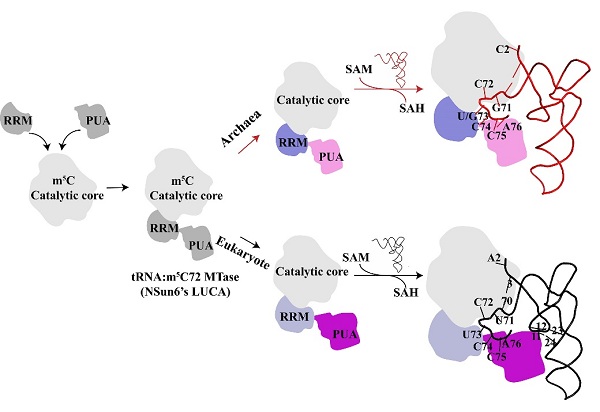
A proposed evolutionary model for eukaryotic and archaeal NSun6