周兆才研究组解析STRIPAK复合物拓扑结构并发现其动态组装调控Hippo通路
来源:
时间:2019-01-12
1月8日,国际学术期刊Cell Discovery在线发表了中国科学院生物化学与细胞生物学研究所周兆才研究组的最新科研成果“Architecture, Sub-structures and Dynamic Assembly of STRIPAK Complexes in the Hippo Signaling”。该成果首次系统性研究了STRIPAK复合物主要成员间的直接相互作用模式及其对Hippo信号通路的装调,解析了相关亚复合物的三维结构,并发现了该复合物响应细胞密度而动态组的现象。
STRIPAK (Striatin-interacting phosphatases and kinases) 复合物是一类在进化过程中高度保守的超分子复合物。该复合物既含有以STRN家族作为调节亚基的PP2A磷酸酶组分,又包含MST等激酶家族成员;除此之外,SLMAP、SIKE1、STRIP1/2、MOB4等也被鉴定为其核心组分。STRIPAK复合物已被报道参与调控包括Hippo信号通路在内的多种生理及病理过程。然而,该复合物的具体拓扑结构及其动态组装目前尚不清楚。
周兆才研究组长期致力于STRIPAK复合物与Hippo信号通路的研究,此前已解析了STRIPAK核心组分STRN3及MOB4的结构(J Biol Chem, 2014; J Biol Chem, 2018),阐释了MST家族激酶的结构与功能机制(Structure, 2013a; Structure, 2013b; J Struct Biol, 2014a; J Struct Biol, 2014b; Nature Immunology, 2015),发现了Hippo信号通路的核内调控新机制(Cancer Cell, 2014; Nat Commun, 2017; Oncogene, 2017; J Exp Med, 2018)。在此基础上,本项工作系统研究了STRIPAK复合物的拓扑结构与动态组装,发现PP2A的调节亚基STRN3作为核心支架蛋白,除了能够直接与Hippo激酶相互作用外,还可以通过两个分子“手臂”以磷酸化依赖的方式“拥抱”Hippo激酶:其中一个手臂是STRIP1,另一个手臂是SIKE1-SLMAP。在解析STRN3-SIKE1以及SIKE1-SLAMP亚复合物的高分辨率三维结构基础上,进一步发现,细胞密度降低能够引发STRIP1的解离,从而揭示了STRIPAK复合物作为Hippo通路上游对不同信号或刺激进行动态感应和集成的功能作用。该成果为今后深入探究STRIPAK复合物与Hippo通路奠定了基础。
研究生汤扬、陈敏、周立和马健是本文共同第一作者,焦石和周兆才老师为共同通讯作者。此项工作得到了中国科学院战略性科技先导专项、国家科技部重点研发计划、国家自然科学基金委杰出青年基金、中科院青年创新促进会的经费资助。研究得到上海光源BL17U和BL18U1线站、生化与细胞所细胞生物学平台、分子生物学平台的支持与帮助。
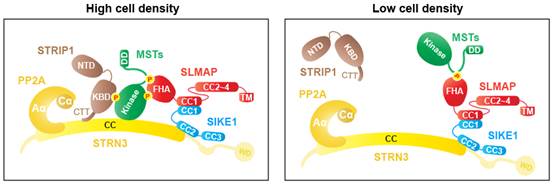
STRIPAK复合物响应细胞密度而动态组装
