2月14日,中国科学院生物化学与细胞生物学研究所周斌研究组在国际学术期刊Stem Cell Reports 上发表了题为“Lineage Tracing Reveals the Bipotency of SOX9+ Hepatocytes during Liver Regeneration”的最新研究成果。该项工作基于更为精准的遗传谱系示踪系统,利用Sox9-CreER和HNF4a-DreER双同源重组技术特异性标记了Sox9+的肝细胞而非Sox9+的胆管细胞。结合基于双同源重组酶的新型Confetti报告基因小鼠,进行克隆分析实验阐明:单个Sox9+的肝细胞在肝损伤后可以同时产生肝细胞和胆管细胞。该项研究首次证明了Sox9+肝细胞在肝损伤后可作为双向祖细胞同时产生肝细胞和胆管细胞参与肝脏修复和再生。
在肝脏稳态情况下,肝细胞更新非常缓慢,而在损伤过程中,肝脏再生能力非常旺盛。肝脏中含有肝脏祖细胞,参与维持肝脏的体内平衡。在损害肝细胞增殖的慢性肝损伤情况下,胆管细胞可以充当干细胞并产生肝细胞参与肝修复再生。此外,肝细胞在某些损伤条件下也可以经历由肝细胞到胆管细胞的转变。这两种主要的上皮细胞群胆管上皮细胞(BEC)和肝细胞在特定的损伤或疾病状况下可以相互产生,但是单个肝细胞是否可以作为双向祖细胞同时产生胆管细胞和肝细胞仍然是未知的。
遗传谱系示踪技术是揭示发育、疾病和再生过程中细胞命运的有效方法。常规的遗传示踪方法在很大程度上取决于驱动Cre重组酶的启动子来确定标记的细胞群。然而,一个基因很大程度上不能精确的定义一个细胞群。例如,Sox9不仅表达在胆管细胞中,还表达在门静脉周围的一群肝细胞中,因此Sox9-CreER就会同时标记门静脉周的肝细胞和胆管上皮细胞。为了更为精确地标记细胞并在体内追踪它们的细胞命运,周斌组的研究人员利用了一种新的交叉遗传学策略,能够特异性标记Sox9+肝细胞而不会标记胆管上皮细胞。
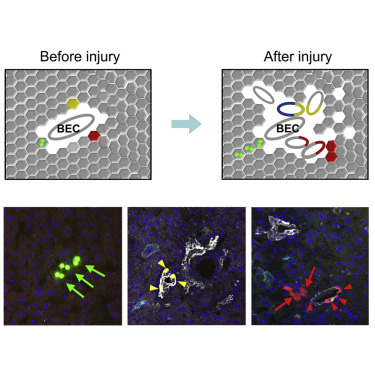
为了研究肝脏损伤后Sox9+肝细胞的细胞动态,研究人员使用了CCl4、肝切和DDC等肝损伤模型。实验结果表明,在CCl4肝损伤模型中,Sox9+的肝细胞快速扩增。胆管结扎(BDL)或DDC模型可以诱导肝细胞转变为BEC。研究人员在BDL(胆管结扎)或DDC诱导的肝损伤模型下观察到Sox9+肝细胞在损伤条件下数量有所减少,但这些细胞确实贡献了BEC。上述数据表明SOX9+肝细胞在不同的损伤模型中有不同的响应。在群体水平,SOX9+细胞具有向BEC和肝细胞转变的潜能。但在单个细胞水平,SOX9+肝细胞在损伤期间是否也具有双向谱系的潜能呢?于是研究人员使用了双同源重组酶介导的新的Confetti报告基因小鼠并结合克隆分析技术,发现Sox9+的肝细胞亚群在单个细胞水平上确实是具有双向分化的潜能,其在肝损伤和修复期间可以同时分化成肝细胞和胆管上皮细胞。
周斌研究组博士生韩溪檬和博士后王越是本文的共同第一作者。该研究工作得到中国科学院、国家基金委、上海市科委等的资助。
文章链接 Sox9+肝细胞的克隆分析。利用响应双同源重组酶的Confetti报告基因小鼠标记单个Sox9+肝祖细胞,发现它具有同时形成胆管细胞和肝细胞的潜能。