程红、云彩红、李劲松、周宇研究组合作首次发现RNA外切复合体“刹车”蛋白
来源:
时间:2019-03-15
3月7日,国际学术期刊Genes & Development在线发表了中国科学院生物化学与细胞生物学研究所程红研究组与北京大学医学部云彩红教授、生化与细胞所李劲松研究员以及武汉大学周宇教授的最新合作研究成果“NRDE2 negatively regulates exosome functions by inhibiting MTR4 recruitment and exosome interaction”。该研究鉴定到首个RNA外切复合体(the RNA exosome complex)的负调控因子NRDE2,阐释了NRDE2抑制RNA外切复合体的多层次功能机制,提供了一种RNA出核和降解的重要调控模式。
基因表达的各个步骤受到严密的控制,进化上高度保守的exosome是RNA质量监控系统的核心元件,几乎参与细胞中每个RNA分子的命运调控。RNA解旋酶MTR4是exosome在细胞核内发挥一切功能所不可或缺的辅助因子。在2017年,程红研究组报道了MTR4通过与mRNA出核因子ALYREF竞争,将新生转录本分选进入出核或降解通路的研究工作(EMBO J,2017)。他们的后续研究发现,被分选进入出核通路的mRNA在细胞核亚结构“核斑小体”(nuclear speckles)中进一步招募出核因子,并获得出核能力(J Cell Biol,2018);进入降解通路的RNA则在细胞核质内被exosome快速清除,新生转录本的快速分选可以避免重要功能蛋白的损耗,并防止异常RNA的出核转运(Nucleic Acids Res, 2018)。然而,RNA分选的调控机制还不清楚。迄今为止,对exosome功能的研究主要集中在其辅助因子的鉴定及功能上,对于其负向调控几乎一无所知。
在本项工作中,研究人员基于前期工作中(EMBO J,2017)利用质谱鉴定到的MTR4相互作用蛋白NRDE2着手开展研究。发现NRDE2与MTR4在体内与体外均紧密结合,并形成1:1的复合体。在细胞中,NRDE2主要定位于核斑小体中,利用一段氮端保守区(MTR4-interacting domain,MID)与MTR4互作,通过抑制MTR4的招募,阻止核斑小体中RNA的降解,并确保其出核转运。进一步的结构研究揭示,NRDE2通过占据MTR4上的关键位点、将MTR4锁定在一种“闭合”构象这两种方式,拮抗MTR4与5'帽结合复合体(CBC)和ZFC3H1等多种重要招募因子间的相互作用,广泛抑制MTR4的招募。尤为有趣的是,NRDE2还抑制MTR4与exosome互作,提供另一重要层面的负向调控。在小鼠胚胎干细胞中,通过删除MID抑制NRDE2对exosome的负向调控,导致其自我更新能力的明显下降,提示这种负向调控具有重要生物学意义。该研究首次发现了exosome的“刹车蛋白”NRDE2,阐释了其抑制RNA降解、促进RNA出核转运的分子机制和生物学意义,揭示了一种调控新生转录本出核或降解的关键模式,并为RNA降解研究领域开拓了新的方向。
程红研究员、云彩红教授、李劲松研究员以及周宇教授为本文章的共同通讯作者。程红组博士研究生王建姝、吴桂芬,云彩红组博士后陈霁云,李劲松组博士研究生张红玲以及周宇组博士研究生杜贤为该文章并列第一作者。本工作得到了北京大学医学部黄超兰教授、中科院大连化物所李国辉研究员、生化与细胞所李党生和黄旲研究员以及中科院上海营养与健康研究院金颖研究员的大力支持,同时得到了国家基金委、科技部及中科院战略性先导科技专项的经费支持。本工作的数据收集还得到了生化与细胞所分子生物学和细胞生物学平台的支持。
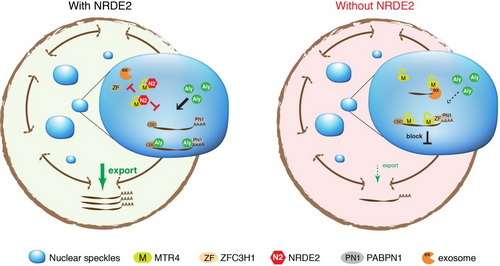
在正常细胞中,NRDE2在核斑小体中与MTR4形成复合体,通过抑制MTR4与exosome复合体及5'帽结合复合体(CBC)、ZFC3H1等多种重要招募因子间的相互作用,广泛抑制MTR4的招募和exosome的功能,从而抑制核斑小体中RNA的降解并确保其高效出核转运
