邹卫国研究组合作发现骨膜来源的前体细胞并建立骨膜来源骨肉瘤模型
来源:
时间:2019-04-24
3月25日,国际学术期刊Journal of Clinical Investigation在线发表了中国科学院生物化学与细胞生物学研究所邹卫国研究组与中山大学肿瘤防治中心康铁邦研究组的最新研究成果“Lkb1 deletion in periosteal mesenchymal progenitors induces osteogenic tumors through mTORC1 activation”。在该项工作中,研究人员发现骨膜来源的Ctsk阳性细胞是成骨前体细胞。在Ctsk阳性细胞中特异性敲除Lkb1,小鼠自发性形成骨肉瘤。
骨骼的发育和稳态由复杂的细胞谱系和调节网络紧密控制。这些细胞命运和调控机制的异常也与癌症的发生和进展密切相关。骨肉瘤作为一种原发性恶性骨肿瘤,好发于青少年,目前主要的治疗手段为化疗和截肢,要开发有效的骨肉瘤的靶向治疗方法,依赖于对肿瘤细胞来源和分子调控机制的进一步认识。
由造血干细胞分化而来的破骨细胞和由间充质干细胞分化而来的成骨细胞分别负责骨的吸收和骨的形成,二者共同维持了骨的稳态。一直以来,组织蛋白酶K (Cathepsin K, Ctsk)被认为是破骨细胞特异性表达的基因,在Ctsk阳性细胞中敲除肿瘤抑制因子Lkb1以后,组织学分析发现敲除小鼠具有类似人类骨肉瘤的表现,而Lkb1在另一破骨前体细胞(LysM-cre)中条件性敲除,并不会导致肿瘤的发生。结合谱系示踪技术和干细胞分离和鉴定实验,研究人员证明了Ctsk阳性的骨膜细胞具有成骨前体细胞的特性。这一结果与另一实验室2018年发表在Nature上的结果互相印证,双方独立证明Ctsk可能标记骨膜中的成骨前体细胞或干细胞。
通过体内示踪,体外细胞培养和异体移植实验,研究人员发现Lkb1缺失的Ctsk阳性细胞大量扩增,并向成骨细胞分化的能力增强,敲除Lkb1以后Ctsk阳性的成骨前体细胞具有形成骨肉瘤的潜能。mTORC1通路作为LKB1的经典下游,在Lkb1条敲小鼠中显著激活,通过分析Lkb1和mTORC1复合物核心因子Raptor双敲小鼠的表型,以及给予Lkb1条敲小鼠注射mTORC1抑制剂Rapamycin后的小鼠表型,发现抑制mTORC1通路可以减缓LKB1条敲小鼠的成骨速率和肿瘤形成速度。有意思的是,之前的研究发现在Ctsk阳性细胞中敲除Ptpn11会导致Hh通路激活,进而导致软骨型肿瘤的发生;而在Lkb1敲除以后导致mTORC1通路的上调则促进成骨性肿瘤的发生。二者研究共同提示Ctsk阳性细胞可能作为一种肿瘤干细胞。通过对肿瘤进行细胞分型,明确发生变化的细胞种类和来源,再进一步通过分子途径进行干预,可能是肿瘤精准治疗的一个方向。
邹卫国研究员和康铁邦教授为该论文共同通讯作者。邹卫国组博士生韩玉娇为该论文第一作者。该研究得到了生化与细胞所季红斌研究员和浙江省人民医院毕擎教授等帮助,经费支持来自中国科学院、国家自然科学基金委、国家科技部、国家杰出科学基金等。该研究得到生化与细胞所细胞分析技术平台和动物实验技术平台等大力支持。
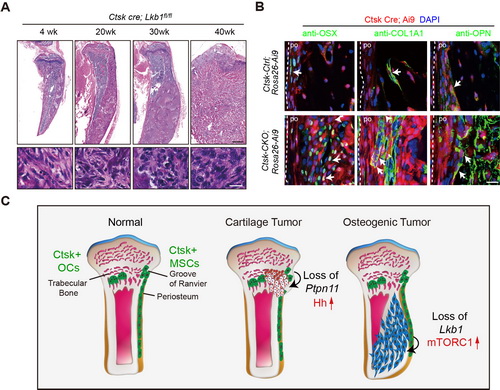
A. 在Ctsk cre表达细胞中Lkb1基因特异性敲除导致小鼠产生成骨性肿瘤;B. 谱系示踪显示骨膜来源的Ctsk阳性细胞是成骨性前体细胞; C. 在骨膜来源的Ctsk+细胞中敲除Lkb1激活mTORC1会导致成骨性肿瘤的示意图。
