惠利健研究组合作揭示损伤再生中肝细胞可塑性的分子基础
来源:
时间:2019-07-04
7月3日,国际知名学术期刊
Cell Stem Cell在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)惠利健研究组与中国科学院上海营养与健康研究所李亦学研究组的合作研究成果:“A Homeostatic Arid1a-Dependent Permissive Chromatin State Licenses Hepatocyte Responsiveness to Liver-Injury-Associated YAP Signaling”。该研究发现染色体重塑调控蛋白Arid1a介导肝细胞重编程基因在正常的肝细胞中预打开,使肝细胞具有响应损伤诱导的YAP信号而转录激活重编程基因的潜能,揭示了肝细胞去分化可塑性的分子基础。
肝脏是体内最重要的器官之一,由于其代谢解毒功能,经常受到各种外来物质的损伤,导致肝脏的再生能力严重下降。因此,研究肝脏损伤再生及其分子调控机制具有重要意义。近年来科学家利用谱系示踪技术发现,门静脉肝脏损伤后主要通过肝细胞重编程的方式实现肝细胞的再生。肝细胞重编程是指肝细胞在受到门静脉肝脏损伤时,去分化成类肝前体细胞,
贡献到肝脏损伤再生。然而对于体内肝细胞发生重编程的分子基础,尤其是表观遗传调控机制,科学家们尚不清楚。
惠利健研究组长期从事肝脏分子病理以及肝细胞重编程相关研究,近年来的代表性研究成果包括:将非肝细胞直接转分化为功能肝细胞(Nature, 2011; Cell Stem Cell, 2014),并以此构建新型生物人工肝装置,救治肝衰竭大动物(Cell Research, 2016);利用肝细胞去分化特性,体外初步实现了人类肝细胞增殖,并证明其体内移植能力(Cell Stem Cell, 2018);合作参与第二军医大学附属长征医院谢渭芬组研究,明确胆管细胞是肝细胞再生的重要细胞来源 (Cell Stem Cell, 2018)。在机制方面,通过对转分化的研究,提出了细胞属性转变过程中的染色体重塑“检查点”理论 (Cell Research, 2017)。
该研究中,科研人员发现负责染色体重塑调控的蛋白Arid1a,特异的调控肝细胞重编程。在肝细胞中敲除Arid1a,会抑制肝脏门静脉损伤所诱导的肝细胞去分化,导致肝脏的损伤修复出现缺陷。进一步通过对分子机制的探索发现,Arid1a通过调控肝细胞重编程基因在正常肝细胞中的预打开,帮助由肝脏损伤活化的转录因子YAP对肝细胞重编程基因的结合,转录激活肝细胞重编程基因的表达,进而促进肝细胞去分化的发生。
该研究主要有以下四项创新点:
第一,首次将染色体重塑蛋白Arid1a介导的表观遗传调控和体内肝细胞重编程调控建立联系。
第二,通过在肝细胞中特异敲除Arid1a发现,抑制肝细胞重编程会导致肝脏损伤再生的缺陷,进一步说明了肝细胞重编程是肝脏损伤再生的一种重要方式。
第三,该研究发现的染色体重塑蛋白Arid1a介导肝细胞重编程基因在正常肝细胞中的预打开,与体外转录因子介导的体细胞重编程过程不同。体外体细胞重编程主要涉及表观遗传修饰的重新建立,转录因子会诱导大规模的染色体重塑。惠利健研究组之前利用小鼠成纤维细胞肝向转分化的系统发现,体外转录因子诱导的肝细胞基因染色体重塑会激活ATM/p53所介导的染色体重塑“检查点”,从而抑制了细胞命运发生的改变。而本研究的发现提示,相对体外肝向转分化,体内肝细胞基因组上重编程相关基因已经处于一个“可塑”状态,损伤诱导肝细胞去分化并不需要剧烈的染色体重塑。
第四,该研究将染色体重塑蛋白Arid1a介导的表观遗传调控和在肝细胞去分化中发挥重要作用的Hipp/Yap信号通路建立了联系。研究发现Arid1a介导的重编程基因预打开帮助了Yap对重编程基因的转录激活,使肝细胞具有响应Hippo/Yap信号通路潜能的分子基础。
中科院分子细胞科学卓越创新中心(生化与细胞所)李维平博士、博士研究生何强和中科院上海营养与健康研究所杨力光博士等为该论文共同第一作者,分子细胞中心惠利健研究员,营养与健康所李亦学研究员、李虹副研究员为共同通讯作者。该工作得到第二军医大学附属长征医院谢渭芬课题组的大力支持。获中科院、基金委、科技部、上海市科委等资助。
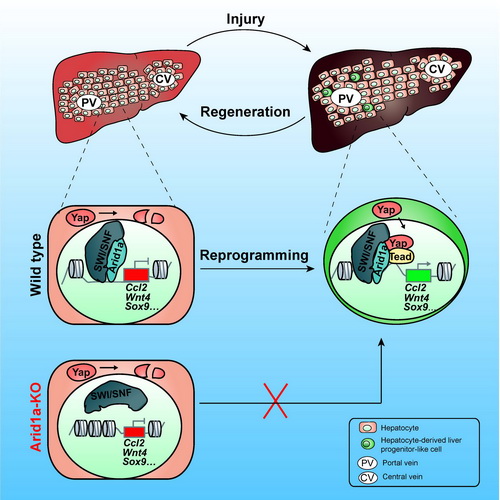
Arid1a调控损伤诱导的肝细胞重编程机制图
