陈玲玲研究组揭示核仁亚显微结构以及新生成核糖体RNA前体定向转运的机制
来源:
时间:2019-09-20
9月17日,国际学术期刊Molecular Cell在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)陈玲玲研究组关于核仁结构以及新生成核糖体RNA前体(pre-rRNA)定向转运的最新研究进展:“Nascent Pre-rRNA Sorting via Phase Separation Drives the Assembly of Dense Fibrillar Components in the Human Nucleolus”该研究通过多种先进成像技术结合生化手段,揭示了核仁的超微三维结构,首次提出了相分离促进新生成pre-rRNA定向转运的模型,并发现了新生成pre-rRNA定向转运过程可以促进核仁致密纤维组分的组装。
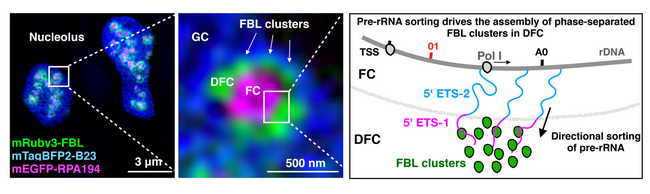
核仁是细胞核内最为重要的无膜细胞核亚结构,主要承担了核糖体RNA的转录、加工以及核糖体组装的功能,并在调控细胞增殖、细胞有丝分裂、响应细胞应激反应中起着重要的作用。基于电子显微镜的观察,核仁中含有FC,DFC以及GC三个独立的核仁亚区域,并认为核仁的层级结构是核糖体RNA转录与加工高度偶联的结果。2017年,陈玲玲研究团队在核仁内发现了名为SLERT的长非编码RNA可以通过调控DDX21环状结构,从而调控核糖体RNA的转录(Cell,2017)。然而由于核仁致密的结构以及高电子密度的特性,核仁亚区域的精细结构,核糖体RNA的转录位置以及核糖体RNA被转录后如何进入DFC区域进行后续的加工尚不清楚。
在这项最新的研究当中,研究人员利用多种超高分辨率显微技术,在人类活细胞当中解析了核仁的超微分辨结构,首次观察到了活跃NORs内的处于活跃与非活跃状态的两种rDNA,发现了DFC区域是非均一结构而是由18-24个簇状结构组成。同时,研究人员利用超高分辨率显微镜在细胞原位确定了rDNA转录位点、rRNA前体的精细定位,以及rRNA前体在FC/DFC转录单元内具有快速定向转运的特性。进一步,研究人员通过筛选,结合生化手段与成像,发现核仁蛋白Fibrillarin(FBL)在新生成rRNA前体转运至DFC这一过程中起到了关键性的作用。进一步研究发现,FBL蛋白中内在无序区域(IDR)的长度决定了FBL自相关强度,并直接影响了FBL对rRNA前体的定向转运能力。总体而言,GAR结构域中FBL中的IDR越长,FBL的自相关特性越强,对rRNA前体的分选能力也越强,并提出由蛋白IDR介导的自相关特性可以促进相分离,从而促进rRNA从其转录位点定向转运进入DFC区域进行加工这一概念,为RNA定位调控机制的研究提供了新的思路。更重要的是,研究首次提出rRNA定向转运过程可以促进核仁DFC区域的组装。事实上,除核仁外细胞内还存在大量的无膜细胞亚结构,该发现也提示类似的机制也可能参与了细胞内其它无膜细胞亚结构的组装。
生化与细胞所博士生姚润文与博士生许光为共同第一作者,陈玲玲研究员为通讯作者。该研究受到了中科院上海营养与健康研究所杨力研究组,中科院植物生理生态研究所公共技术服务中心、国家蛋白质科学中心(上海)复合激光显微成像系统、中科院上海生物化学与细胞生物学研究所细胞分析技术平台,上海科技大学免疫化学研究所影像平台,中科院深圳先进技术研究院储军副研究员,GE Healthcare Life Sciences(上海)、Leica Microsystems(上海)、Nikon instruments (上海)的大力支持。