丁建平研究组合作揭示酵母TORC1信号通路重要调控机制
来源:
时间:2019-09-27
真核细胞中高度保守的TORC1蛋白激酶复合物通过感受和整合外界生长因子、能量状态和营养水平等,调控细胞生长发育和自噬等重要生命过程。该信号通路的功能失调会引起多种疾病,包括肥胖症、糖尿病和多种癌症等。氨基酸是TORC1信号通路的重要激活因子。在高等真核生物中,氨基酸通过激活Rag小G蛋白复合物,由Ragulator五元复合物和Rag小G蛋白共同介导 TORC1在溶酶体上的定位和激活过程。但是在酵母中TORC1信号通路的调控机制还不清晰。
丁建平研究组长期从事TORC1信号通路调控的分子机制研究,先后测定了人源TORC1信号通路中一些重要调控蛋白包括Rheb、TCTP、S6K和CASTOR1等的结构,近期又测定了人源Ragulator五元复合物的晶体结构 ,阐明了Ragulator复合物的组装机制和招募Rag小G蛋白的作用机制(Nature Communications,2017)。同时,也对酵母TORC1信号通路展开了深入研究。通过与瑞士Fribourg大学Claudio De Virgilio研究组展开合作,首先完成了酵母TORC1信号通路中Ego1-Ego2-Ego3(EGO-TC)三元复合物的晶体结构测定和功能分析(Structure,2012 ;Cell Research,2015)。在此基础上,丁建平研究组的副研究员张天龙和De Virgilio研究组的博士后Marie-Pierre Péli-Gulli合作,测定了EGO-TC与酵母Rag小G蛋白的同源蛋白Gtr1-Gtr2共同形成的五元复合物(EGOC)的晶体结构,发现在EGOC复合物中由Ego1介导EGO-TC和Gtr1-Gtr2两个亚复合物的组装机制。通过结构分析和功能实验,发现EGO-TC作为骨架蛋白发挥功能,通过Ego1 的N端结构域和Ego3分别与Gtr2和Gtr1的Roadblock结构域结合,招募Gtr1-Gtr2在酵母囊泡上的定位。通过结构比较发现,人源Ragulator复合物和酵母EGO-TC虽然不具有序列相似性,并且亚基数量也不一致,但是与小G蛋白Rag/Gtr相互作用的方式非常相似,表明这两个复合物在TORC1信号通路中发挥相似的功能。这些研究结果进一步阐释了真核生物中氨基酸等营养物质对TORC1信号通路的调控机制和保守性。
该项工作得到国家自然科学基金委等项目的经费支持。感谢上海光源17U1线站和国家蛋白质科学研究设施(上海)19U1线站的工作人员在实验数据收集中的支持与帮助。
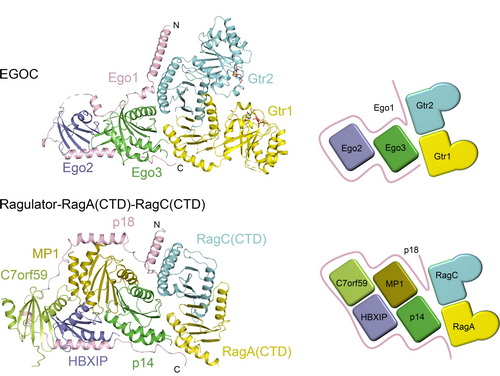
酵母EGOC与人源Ragulator-RagA(CTD)-RagC(CTD)复合物的结构比较
