陈勇研究组揭示MLL1甲基转移酶复合物的组装和活性调控新机制
来源:
时间:2019-09-27
9月23日,国际学术期刊Nucleic Acids Research在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)国家蛋白质科学中心(上海)陈勇研究组的最新研究成果“The internal interaction in RBBP5 regulates assembly and activity of MLL1 methyltransferase complex”, 揭示了全长RBBP5参与MLL1甲基转移酶复合物的组装和活性调控的结构基础和新的分子机制。
组蛋白甲基化在许多生物学过程比如异染色质的形成、X染色体的失活、转录调控中起到了重要的作用,其甲基化水平的异常能导致多种遗传疾病和癌症的发生发展。在哺乳动物体内,组蛋白H3第4位赖氨酸的甲基化主要由MLL家族蛋白成员(MLL1/2/3/4, SET1A/B)共同行使。其中研究最多的是混合谱系白血病蛋白MLL1 (Mixed Lineage Leukemia 1),它能与70多种基因发生重排形成融合蛋白。产生的MLL1 融合蛋白因其复合物组装和酶活异常,造成机体的造血功能障碍而引发白血病。因此,MLL1是一个潜在的白血病治疗靶标,研究其复合物的组装和活性调控的分子机制有重大的意义和潜在的应用价值。
与其它甲基转移酶家族不同,MLL家族甲基转移酶的激活受到RBBP5、ASH2L、WDR5这些辅助蛋白的共同调控。其中,RBBP5作为支架蛋白,在MLL1复合物的组装和酶活调控中起到了巨大的作用。陈勇研究组的前期工作揭示了RBBP5中的一段保守多肽(RBBP5AS+ABM)调控MLL家族蛋白活性的结构基础和分子机制(Nature, 2016),但全长RBBP5蛋白参与MLL1甲基转移酶复合物的组装和活性调控的分子机制仍值得深入研究。
在陈勇研究员的指导下,博士研究生韩建明、李婷婷等研究人员首次揭示了RBBP5存在内部的相互作用,并且这种相互作用会显著增强MLL1复合物的活性。为找出该蛋白内部发生相互作用的关键氨基酸,研究人员解析了RBBP510-480高分辨的晶体结构。他们借助生化实验鉴定出其内部发生相互作用的关键氨基酸,并设计突变去破坏内部相互作用后能显著降低MLL1复合物的活性。接着,研究人员运用生物小角散射技术,揭示在溶液状态中RBBP5内部的相互作用可以使MLL1复合物的组装更为紧凑。反之,若相互作用被破坏,则使其整体结构变得松散。令人惊喜的是,研究人员经序列分析首次揭示了RBBP5的C末端存在一个哺乳动物特有的CTD3 motif。经生化实验表明,富集赖氨酸的CTD3能高度亲和核小体DNA,增强MLL1复合物与核小体的相互作用,继而促进复合物酶活的高效发挥。若将这些赖氨酸全部突变为丙氨酸,会削弱MLL1复合物结合核小体的能力,对其酶活发挥产生负调控。综上,该研究成果揭示了全长RBBP5参与MLL1复合物组装和活性调控的新机制,为进一步研究MLL家族复合物的动态调控奠定了基础。
生化与细胞所博士研究生韩建明为本文第一作者,陈勇研究员为通讯作者。感谢张江实验室李娜博士、彭超博士、华东理工大学全舒研究员的大力支持和帮助。该研究得到张江实验室国家蛋白质科学研究(上海)设施BL19U1晶体衍射线站、BL19U2小角散射线站、质谱分析系统和规模化蛋白质制备系统的大力支持和帮助。该研究工作获得中科院战略性先导计划和国家自然科学基金委的经费资助。
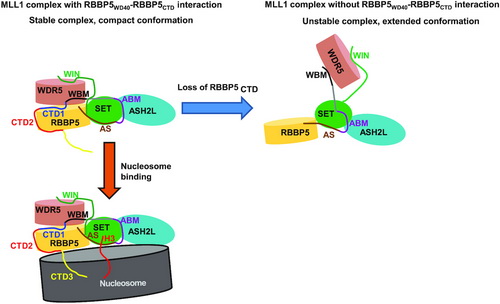
RBBP5调控MLL1复合物活性的结构模型
