周斌研究组揭示肺脏支气管肺泡干细胞(BASC)具有双向分化潜能
来源:
时间:2020-01-13
1月7日,国际学术期刊
Cell Discovery在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周斌研究组的科研成果“Bi-directional differentiation of single bronchioalveolar stem cells during lung repair”。
该研究基于双同源重组报告系统,利用细胞克隆分析技术揭示了单个支气管肺泡干细胞(single BASC)在支气管和肺泡区域都损伤情况下具有同时再生这两个区域上皮细胞的能力。这一发现为肺脏的再生治疗提供了新的理论指导。
作为一个复杂的多功能器官,肺脏对人类的生存至关重要。肺上皮细胞对肺脏稳态的维持及肺损伤后修复再生具有重要作用。肺脏自上端到末端结构主要包括气管、支气管、小支气管和肺泡区域。肺脏呼吸道不同的区域具有不同种类的上皮细胞。气管和支气管的上皮细胞主要包括纤毛细胞、棒状细胞、杯状细胞和基底细胞等;小支气管上皮主要包括纤毛细胞、棒状细胞和神经内分泌细胞;肺泡区域上皮主要由I型肺泡上皮和II型肺泡上皮组成。以往的研究普遍认为不同区域的上皮细胞维持各自区域的稳态。
2005年,Kim研究团队通过体外验证,首次提出在小支气管与肺泡交界处(bronchioalveolar juct junctions, BADJs)存在一群多能性干细胞,具有同时表达支气管上皮棒状细胞分子标记Scgb1a1(又称为CC10)和II型肺泡上皮细胞分子标记Sftpc(又称为SPC)的特点,这群细胞被称为支气管肺泡干细胞(bronchioalveolar stem cells, BASCs)(Kim et al., 2005, Cell)。由于Kim团队的研究缺乏体内的直接证据,周斌研究组利用双同源重组细胞首次在体内证实了BASCs的存在,并通过命运图谱分析证实了BASCs在体内具有多能性,其在支气管上皮损伤后能向支气管方向增殖分化为支气管上皮棒状细胞和纤毛细胞;而在肺泡区域损伤后能向肺泡方向增殖分化为
I型和II型肺泡上皮细胞 (Liu et al., Nature Genetics, 2019)。以上的分析结果是对BASCs细胞群进行的命运图谱分析,然而单个BASC在支气管和肺泡同时损伤情况下,是否能展现出更强的增殖分化能力而同时再生支气管和肺泡两个区域的上皮细胞呢?
为了解决这个问题,研究人员对传统的克隆分析工具
R26-Confetti进行了改造,改进成了受双同源重组调控的克隆分析报告系统,称为
R26-Confetti2。当细胞内同时发生Dre-rox和Cre-loxP重组后,这个细胞会随机表达RFP,YFP,或nGFP基因,此工具可应用于对双阳性的单细胞进行克隆分析。研究人员首先对
Sftpc-DreER;Scgb1a1-CreER;R26-Confetti2三基因型小鼠进行低剂量的Tamoxifen诱导,因为BASC同时表达DreER和CreER,这样可将单个BASC随机标记成RFP,YFP,或nGFP。之后依次进行萘(Naphthalene)和博来霉素(Bleomycin)损伤,来依次损伤支气管上皮和肺泡上皮。等肺脏再生修复后收取肺脏组织进行免疫荧光染色分析。分析结果证明,
单个BASC在支气管和肺泡上皮都受损情况下,可以向支气管方向分化再生为支气管上皮棒状细胞和纤毛细胞,同时也可以向肺泡方向分化再生为I型和II型肺泡上皮细胞。总结来说,在损伤修复中,单个BASC在体内具有双向分化潜能,为肺脏再生治疗提供了新的思路。
该研究工作在周斌研究员的指导下,由研究生刘扩等完成,并得到了季红斌研究员的大力支持。同时得到中国科学院、国家基金委、国家科技部、上海市科委等资助。
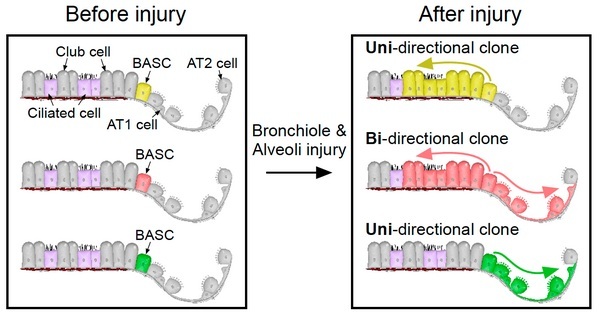
单个标记的BASC在损伤下具有向支气管和肺泡区域双向分化潜能
