杨荟研究组揭示编码在转座子的新型CRISPR-Cas系统靶向DNA的作用机制
来源:
时间:2020-01-14
1月8日,国际学术期刊Cell Research在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)杨荟研究组题为“Structural basis of a Tn7-like transposase recruitment and DNA loading to CRISPR-Cas surveillance complex“的研究成果。该研究阐明了霍乱弧菌I-F 亚型Cascade效应复合物招募Tn7样转座子亚基TniQ的分子机制,及Cascade-TniQ复合物对DNA的序列特异性识别过程,对潜在新型基因编辑工具的开发具有重要指导意义。
CRISPR系统是原核生物体内由RNA介导的,序列特异性识别外源核酸,并通过核酸内切酶对其进行切割的获得性免疫系统。早先的研究发现几种核酸内切酶基因缺失的I-F、I-B和V-K亚型CRISPR系统与DNA靶向亚基缺失的Tn7样转座子在进化和功能上相关。进一步的研究表明,这类I-F和V-K亚型CRISPR系统可与转座相关蛋白共同作用,在大肠杆菌细胞全基因组范围内实现RNA介导的DNA特异位点插入。在霍乱弧菌中,转座蛋白TniQ可与I-F 亚型Cascade效应复合物直接作用,并在DNA插入过程发挥关键作用。CRISPR系统与Tn7样转座系统介导的DNA插入不依赖CRISPR系统产生DNA双链断裂,进而不依赖细胞内源DNA修复途径,为基因编辑提供一种全新的模式。然而,这一过程的分子机制并不清楚。
在本项研究中,研究人员利用X-射线晶体衍射技术和单颗粒冷冻电镜技术分别解析了apo-TniQ的晶体结构和Cascade-TniQ复合物与DNA结合前后的电镜结构。霍乱弧菌的Cascade复合物由Cas6、Cas7、Cas8(Cas5和Cas8基因融合蛋白)和crRNA以1:6:1:1的比例组装而成,整体结构与已报道I-F亚型其他Cascade复合物较为相似。Cas6位于复合物头部并结合crRNA的3’茎环部分,Cas8位于复合物尾部并结合crRNA的5’端,6个Cas7形成复合我的的骨架并结合crRNA的间隔区(spacer)。底物DNA结合后,Cas8通过DNA双链小沟序列特异性识别PAM序列,并稳定被打开的DNA双链。目标DNA链与crRNA的间隔区互补配对形成DNA-RNA杂交链,由6个Cas7稳定。TniQ形成同源二聚体结合在Cascade复合物头部,分别与Cas6和Cas7.1相互作用。DNA结合后,Cascade-TniQ复合物发生微小变化,crRNA螺旋轴增长,复合物整体构象更为伸展。本项工作的研究成果阐明了转座蛋白TniQ与Cascade复合物的组装机制以及Cascade-TniQ复合物识别DNA的分子机制,深入理解RNA介导的DNA位点特异性插入的起始过程,为新型基因编辑方式的开发提供结构信息。
杨荟研究员为本文通讯作者,硕士研究生王蓓蓓为第一作者。感谢张江实验室国家蛋白质科学研究设施(上海)冷冻电镜系统、18U、19U1线站以及上海同步辐射光源17U线站的工作人员在数据收集时提供的支持和帮助。该研究工作得到国家自然科学基金委项目的经费支持。
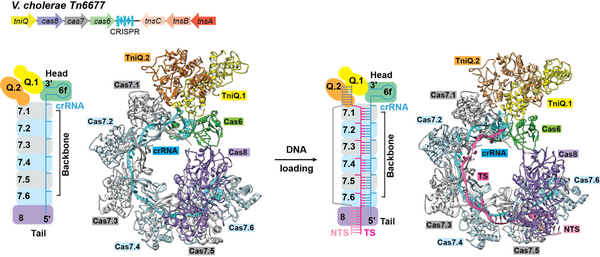
Cascade-TniQ复合物的组装及对DNA的识别
