鲍岚研究组合作发现胰腺炎相关蛋白-I在神经病理性痛中的作用及机制
来源:
时间:2020-01-14
1月8日,国际学术期刊The Journal of Neuroscience在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)鲍岚研究组和中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)张旭研究组的合作研究成果:Nerve Injury-Induced Neuronal PAP-I Maintains Neuropathic Pain by Activating Spinal Microglia。该研究发现外周神经损伤引起感觉神经元表达胰腺炎相关蛋白-I(PAP-I),并参与了长时程的神经病理性痛的维持过程。
神经病理性痛是由神经损伤引起的一种长时程疼痛过程。尽管到目前为止,已经有不少工作试图来揭示神经病理性痛的发生发展机制,但是对于其长时程的维持机制始终知之甚少。胰腺炎相关蛋白(Pancreatitis-associated protein,PAP)属于钙离子依赖性凝集素家族,是一种小分子量的分泌蛋白。在神经系统中,已有研究发现PAP蛋白参与神经损伤后再生的过程。但是,PAP蛋白是否在疼痛发生发展过程中起作用并不清楚。
研究团队发现,PAP-I在神经病理性痛模型大鼠背根神经节(Dorsal root ganglia,DRG)神经元中表达显著升高,提示PAP-I可能在慢性痛发生发展过程中发挥作用。在神经损伤后,PAP-I的表达分布经历从小直径神经元到大直径神经元再向小直径神经元转变的过程,DRG神经元生成的PAP-I可以同时向外周和脊髓背角运输。行为学实验显示,鞘内而不是足底给予外源PAP-I蛋白可诱导痛敏反应,说明外周神经损伤诱导表达的并向脊髓背角运输的PAP-I具有促痛作用。与此同时,研究还发现PAP-I敲除大鼠在神经损伤后可以建立痛敏反应,但是随着时间的推移,第43天后机械触诱发痛有显著的减轻,提示了PAP-I在神经病理性痛维持过程中的作用。进一步研究PAP-I的作用机制时发现,PAP-I可以作用于CC-趋化因子受体2(CC-chemokine receptor 2,CCR2),并通过CCR2-p38 MAPK途径激活脊髓小胶质细胞。给予大鼠小胶质细胞抑制剂或者CCR2抑制剂能够有效缓解PAP-I引起的痛敏反应。因此,外周神经损伤后,DRG神经元通过释放促痛因子PAP-I来维持长时程的神经病理性痛过程。
该研究由张旭研究员和鲍岚研究员指导,张旭组博士研究生李佳音、鲍岚组史海翔博士研究生为该论文共同第一作者,同时张旭组的刘辉和董飞博士、陆莹瑾也做出了贡献,并得到中国科学院分子细胞科学卓越创新中心陈洛南研究员和刘志平博士的大力协助。本工作得到国家自然科学基金委、中国科学院前沿科学重点研究项目、中科院战略先导(B类)科技专项、上海市科技重大专项等项目的资助。
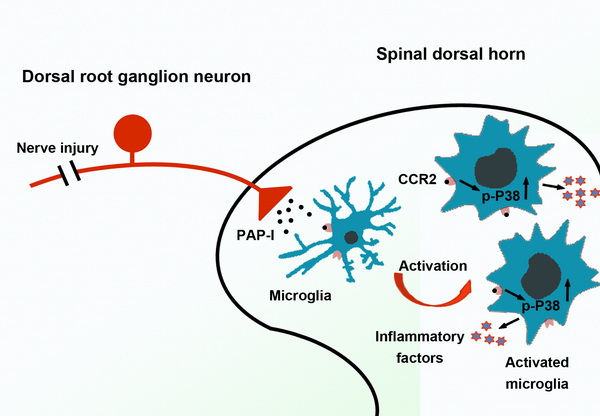
外周神经损伤诱导DRG神经元生成PAP-I,向脊髓背角运输的PAP-I能够通过CCR2-p38 MAPK途径激活小胶质细胞,参与神经病理性痛的维持过程。
