周斌研究组构建一种自我剪切的诱导型Cre重组酶实现可控性高效遗传操作
来源:
时间:2020-02-18
2月17日,国际学术期刊The EMBO Journal以封面文章在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周斌研究组的最新科研成果“Generation of a self-cleaved inducible Cre recombinase for efficient temporal genetic manipulation”。该研究构建了一种新的诱导型Cre重组酶,可通过自我剪切将诱导型CreER转变成持续活化的Cre,实现时间可控的高效遗传操作。这种新型Cre重组酶结合了诱导型CreER和持续活化的Cre重组酶的优点,既提高了重组效率又具有时间可控性,弥补了传统CreER和Cre重组酶介导的遗传操作技术的缺陷,突破了长期阻碍基因功能研究的瓶颈,可广泛应用于器官发育、组织再生和疾病进程中的基因功能研究。
位点特异性重组酶Cre介导的遗传操作技术,广泛应用于谱系示踪、基因异位表达和组织特异性基因敲除等研究,为了解器官发育、组织再生和疾病进程中体内细胞行为和基因功能提供了关键依据。然而,Cre-loxP介导的遗传操作技术长期存在的缺陷和不足,已成为阻碍特定基因功能研究的瓶颈。目前存在的主要缺陷和不足表现在:持续活化的Cre敲除基因的效率较高,但敲除基因的时间点不可控,导致基因敲除可能发生在发育早期或非预期的实验时间窗。诱导型CreER虽具有时间可控性,提高了遗传操作的精确度,但敲除基因效率较低。为了提高诱导型CreER的基因敲除效率,需要高剂量且多次给予tamoxifen诱导,这不仅对实验小鼠有毒副作用、长期影响其健康状况,而且会引起基因敲除以外的一些混淆的表型。
为了弥补传统CreER和Cre重组酶介导的遗传操作技术存在的缺陷,周斌组研究人员构建了一种可自我剪切的诱导型CreER(self-cleaved inducible CreER, sCreER)重组酶,在ER表达盒的两侧插入两个loxP位点,经tamoxifen诱导后,sCreER重组酶入核与ER两侧的loxP位点发生重组,通过自我剪切的方式由诱导型CreER转变为持续活化的Cre重组酶。sCreER重组酶介导的遗传操作,在降低tamoxifen用药剂量、减少给药次数、减轻对实验小鼠毒副作用的同时,实现高效率且时间可控的基因敲除。
利用这种新型的Cre重组酶,研究人员构建了心内膜细胞表达的Npr3-sCreER和成纤维细胞表达的Col1a2-sCreER转基因小鼠,并与传统Npr3-CreER和Col1a2-CreER转基因小鼠进行了比较。与易于重组的等位基因如R26-tdTomato发生重组时,sCreER与传统CreER的重组效率无显著差异。而与相对难以重组的R26-Confetti、R26-LZLT(周斌组新构建的一种报告基因R26-loxP-ZsGreen-loxP-tdTomato)、R26-GFP或VEGFR2flox/flox等位基因发生重组时,sCreER的重组效率显著高于传统CreER。与传统CreER相比,sCreER显著提高了诱导基因表达或敲除的重组效率,能够实现时间可控且高效的体内基因组修饰,将会推动器官发育、组织再生和疾病进程中特定细胞谱系的基因功能研究。
周斌研究员是本文的通讯作者,暨南大学田雪莹研究员是本文的第一和共同通讯作者。此项研究得到了南京医科大学季勇教授、南方医科大学乔增勇教授和香港中文大学吕爱兰教授等的大力支持。该项研究工作得到科技部、国家自然科学基金委、中国科学院、上海市科委等的经费资助。
文章链接
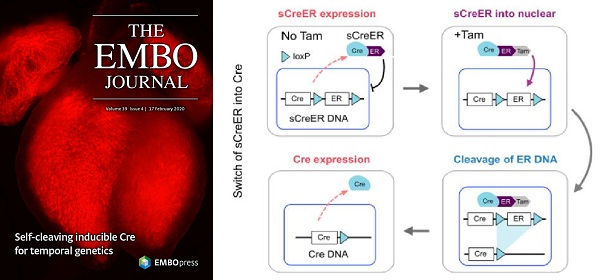
sCreER重组酶通过自我剪切由CreER转变成Cre的原理图
