杨巍维研究组发现肿瘤相关巨噬细胞促进肿瘤恶性进展的新机制
来源:
时间:2020-03-18
7月19日,国际学术期刊Molecular Cell在线发表了中国科学院生物化学与细胞生物学研究所杨巍维研究组的最新研究成果:“Macrophage-associated PGK1 phosphorylation promotes aerobic glycolysis and tumorigenesis”。该研究揭示了肿瘤相关巨噬细胞通过调控肿瘤细胞中PGK1的磷酸化调控肿瘤细胞的糖酵解,从而促进了多形性神经胶质母细胞瘤的发展。
肿瘤微环境是肿瘤细胞赖以生存的复杂环境,主要由多种不同的细胞外基质和基质细胞组成。肿瘤相关巨噬细胞(Tumor-associated macrophages, TAMs)是浸润在肿瘤组织中的巨噬细胞,是肿瘤微环境中最多的免疫细胞。研究表明肿瘤相关巨噬细胞可以通过多种途径促进肿瘤细胞的生长及转移,但其是否能调控肿瘤细胞的代谢并不清楚。
杨巍维组的最新研究表明,TAMs分泌白介素6(interleukin 6, IL6)作用于胶质瘤细胞,促进胶质瘤细胞中3-磷酸肌醇依赖的蛋白激酶1(3-phosphoinositide-dependent protein kinase 1, PDPK1)介导的PGK1第243位苏氨酸(T243)的磷酸化。PGK1 T243磷酸化后改变了PGK1和底物的亲和力从而促进了PGK1糖酵解方向的活性,促进了胶质瘤细胞的有氧糖酵解、细胞增殖和肿瘤生长。通过使用IL6中和抗体、抑制肿瘤细胞中PDPK1活性或者PGK1 T243磷酸化,可以抑制TAMs促进的胶质瘤细胞的有氧糖酵解、细胞增殖和肿瘤生长。
通过对大量胶质瘤病人样本进行免疫组化分析,研究人员发现PGK1 T243磷酸化与PDPK1活性、TAMs的浸润、IL6的表达密切相关;结合病人预后资料,他们进一步发现PGK1 T243磷酸化和胶质瘤的等级成正相关,和胶质瘤病人的预后成负相关。
该工作首次揭示了微环境中的巨噬细胞可通过调控肿瘤细胞代谢以促进肿瘤生长的新机制;建立了蛋白翻译后修饰对代谢酶催化方向调控的新模式;提示了PGK1 T243磷酸化可作为指示胶质瘤预后的生物标志物,并为胶质瘤的治疗提供了新策略,即抑制PGK1的磷酸化来切断TAMs和肿瘤细胞之间的连接。
杨巍维研究员和大连化物所李国辉研究员为该论文的共同通讯作者。杨巍维组博士研究生张亚娟、龙华医院于观贞教授和大连化物所楚慧郢博士为该论文的共同第一作者。该项研究工作得到了中国国家自然科学基金、中国科学院战略优先研究项目资助。该研究数据收集工作得到生化与细胞所公共技术服务中心分子平台和动物平台的支持。
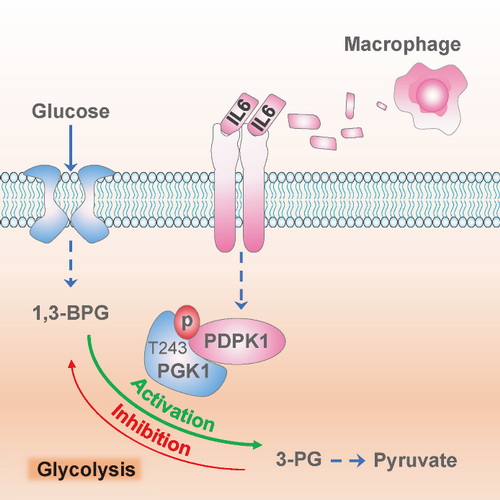
巨噬细胞通过分泌IL6诱导了肿瘤细胞中PDPK1介导的PGK1磷酸化来调节PGK1催化反应的方向,从而增强了肿瘤细胞的糖酵解,并最终促进了肿瘤的恶性进展。
