王红艳研究组揭示调控CD8+细胞毒性T淋巴细胞表达PD-1和杀伤肿瘤的新机制
来源:
时间:2020-03-18
2015年4月7日,国际学术期刊EMBO Molecular Medicine在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所王红艳研究组的研究成果“ADAP and SKAP55 deficiency suppresses PD‐1 expression in CD8+ cytotoxic T lymphocytes for enhanced anti-tumor immunotherapy”。该项研究发现免疫衔接蛋白ADAP和SKAP55通过升高抑制性受体PD-1的表达,阻断CD8+细胞毒性T淋巴细胞(CTL)杀伤肿瘤的能力。
CD8+ CTL能特异性杀死肿瘤细胞, 在抗肿瘤免疫中起到了重要作用。然而,肿瘤微环境会诱导CD8+ T细胞升高抑制性受体PD-1的表达,通过与肿瘤细胞表面的配体PD-L1结合后,显著抑制CD8+ CTL清除肿瘤细胞的能力。大量的基础研究和临床实验已经证明抗PD-1或抗PDL-1的抗体能显著增强机体清除肿瘤的效率。今年1月美国FDA批准抗PD-1抗体用于治疗黑色素瘤病人。但是,目前仍未完全理解PD-1表达调控的分子机制。
在王红艳研究员的指导下,博士研究生李春阳等人发现CD8+ T细胞缺失信号分子ADAP和SKAP55后,阻断抗原刺激所诱导的PD-1上调表达,显著增强CD8+ CTL杀伤肿瘤细胞的能力。通过深入探讨相关的分子机制,本研究发现ADAP和SKAP55通过促进转录因子NFATc1的表达和活化,上调PD-1表达,并且这一过程依赖于Ca2+ 和Fyn激酶。为检测活体抗肿瘤效果,本研究建立三种小鼠肿瘤模型。首先,建立了利用树突状细胞(DC)疫苗预防和治疗黑色素瘤或淋巴瘤的模型,发现缺失SKAP55和ADAP的小鼠显著阻碍肿瘤形成和肺部迁移,并且肿瘤中浸润的CD8+ CTL降低了PD-1的表达。此外,利用过继性转移缺失SKAP55或ADAP的CD8+ CTL到野生型受体小鼠的模型,发现其清除体内肿瘤的效果明显高于野生型CD8+ CTL。该项研究提出阻断ADAP-SKAP55-NFATc1-PD1信号通路,以促进肿瘤免疫疗效的策略,并且提出PD-1表达调控的新机制。
本课题与中国科学院武汉病毒研究所魏滨研究员合作完成,并感谢英国剑桥大学Christopher E Rudd教授,中科院上海巴斯德所冷启彬研究员和上海师范大学盛春教授的大力支持。该项研究工作得到国家科技部、基金委、上海浦江计划等经费的支持。
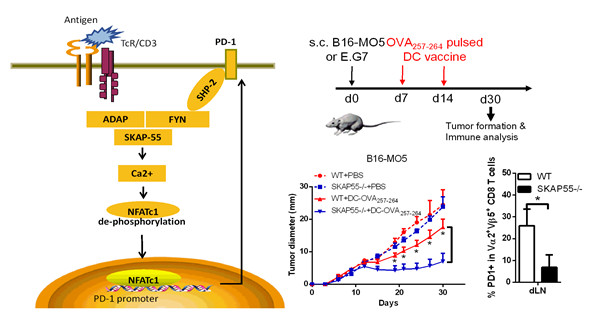
信号复合物ADAP-SKAP55促进CD8+ T细胞表达抑制性受体PD-1的模式图;SKAP55缺失的小鼠增强DC疫苗介导的治疗肿瘤(如淋巴瘤或黑色素瘤)的效果。
