沈义栋研究组发现一分泌型microRNA可跨组织传递抑制自噬的衰老信号
来源:
时间:2020-03-23
10月23日,国际学术期刊Nature Communications在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)沈义栋实验室的最新研究成果:“A secreted microRNA disrupts autophagy in distinct tissues of Caenorhabditis elegans upon ageing”。该研究发现一个分泌型的microRNA可以在组织间传递,并在衰老过程中抑制了多个组织中的自噬活性。
生物的衰老往往伴随着蛋白稳态的失调,自噬作为维持蛋白稳态的重要环节,其活性也随着衰老逐渐下降。抑制自噬会加速衰老并导致多种老年性疾病的发生,同时很多长寿通路都依赖激活自噬延长生物的寿命,这说明了自噬对于衰老的调控至关重要。但是随着自然衰老,自噬被逐渐抑制的分子机制却还不清楚。另外,与其他蛋白稳态调控方式一样,各组织中的自噬活性也是被协同调控的,但是其中传递信号的分子还有待探究。
沈义栋组的最新研究发现随着衰老hsf-1/HSF1在线虫肠道中激活了mir-83/miR-29的表达,这导致了mir-83的下游靶基因cup-5/MCOLN的表达被抑制。cup-5作为一个溶酶体蛋白,其表达量的降低会影响溶酶体的数量及功能,进而抑制了肠道中的自噬。尽管mir-83不在肌肉组织中被转录,但是研究人员发现肠道中成熟的mir-83序列(mature miR-83)可以被运输到体腔和肌肉细胞中,然后通过同样的分子机制抑制肌肉中的自噬,最终导致了线虫整体性的衰老。研究人员还发现miR-83的跨组织运输很有可能是通过胞外囊泡实现的。
该项研究发现了一个保守的microRNA可以作为衰老信号的传递因子,仅在肠道中被衰老激活,但可以被跨组织传递并通过抑制溶酶体控制不同组织中的自噬,进而系统性地调控蛋白稳态及线虫寿命。这些研究结果不但揭示了衰老影响自噬的一个重要的分子机制,更表明了分泌性microRNA作为组织间信号分子在跨组织自噬调节中的重要作用。分泌性microRNA也广泛存在于高等动物的体液中,并已被认为是衰老与其它诸多疾病的重要标志物。这项研究表明这些标志物存在着重要的潜在作用,为未来研究、干预哺乳动物乃至人类的衰老与其相关疾病的研究具有重要的指导意义。
生化与细胞所沈义栋研究员为该论文的通讯作者,沈义栋组博士研究生周一飞为该论文的第一作者。该项研究得到了国家自然科学基金、中国科学院战略先导专项资助。该研究得到了生化与细胞所景乃禾研究员,中科院广州生物医药与健康研究院彭广敦研究员,德国马克斯普朗克衰老研究所Adam Antebi教授和德国海德堡大学Christoph Dieterich教授的大力支持。该研究数据收集工作得到生化与细胞所公共技术服务中心分子平台和细胞平台的大力支持。
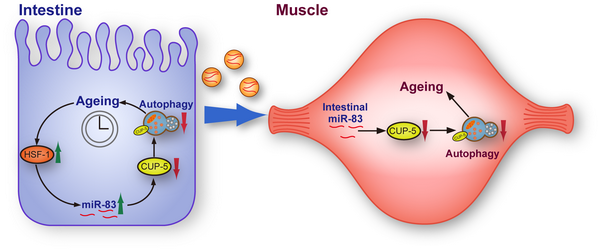
随着衰老,肠道中的miR-83的表达被激活,并作为一种衰老信号被胞外囊泡运输到肌肉组织中,通过抑制溶酶体功能降低了多个组织中自噬活性。
