胡荣贵研究组合作发现泛素信号调控哺乳动物青春期发育起始新机制
来源:
时间:2020-05-14
近期,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)胡荣贵研究组、中国科学院上海营养与健康研究所李亦学研究组与中国科学院苏州生物医学工程与技术研究院高山研究组合作在National Science Review杂志上在线发表了题为“MKRN3 regulates the epigenetic switch of mammalian puberty via ubiquitination of MBD3”的研究成果,该研究阐述了哺乳动物下丘脑中泛素连接酶MKRN3通过泛素化修饰表观遗传学重要调控因子MBD3,影响MBD3与GNRH1启动子区及TET2的结合,抑制GNRH1的基因表达水平,进而关闭青春期发育起始开关的表观遗传学机制。同时该研究也阐述了MKRN3突变导致家族性中枢性性早熟发病的分子机理。
2005年,《科学》(Science)在庆祝成立125周年之际,提出了125个未解决的“大”科学问题来预测和推动下一世纪的活跃研究,其中就包括 “什么触发了青春期? (what triggers puberty?)”。哺乳动物的青春期受下丘脑-垂体-性腺(hypothalamic-pituitary-gonadal,HPG)轴的控制,且与年龄关系密切,在青春期发育起始时下丘脑促性腺激素释放激素(GnRH)的释放会特异性增加。HPG轴的过早激活会导致中枢性性早熟(central precocious puberty, CPP),它是一种常见的儿科神经系统疾病,全球范围内发病率1/5000-1/10000,而CPP与多种成年后的疾病风险相关,包括多种类型的癌症、肥胖症、2型糖尿病、心血管疾病等。2013年Abreu等人的研究揭示约有30%家族性CPP(FCPP)存在MKRN3(Makorin3)基因的突变或缺失,且发现随着青春发育的进行MKRN3的表达逐步减少。后续全球范围内的许多研究者陆续证实了该项研究,但其突变导致CPP的具体分子机制一直未被系统的阐述。
在该研究中,研究人员首先构建了Mkrn3敲除小鼠模型,并鉴定到类似于人CPP的症状。接着筛选到了MKRN3的新底物蛋白MBD3 (Methyl-CpG DNA Binding Protein 3)。研究发现,MBD3可以通过结合GNRH1的启动子区及TET2蛋白分子,在表观遗传学水平协同促进GNRH1基因启动子的去甲基化,而促进GNRH1的表达。MKRN3 可以通过泛素化修饰MBD3,同时既减弱MBD3与GNRH1启动子区的结合,也不利于招募TET2从而使得GNRH1的甲基化程度提高,从而抑制GNRH1的表达,HPG轴也由此处于失活状态,青春期发育也就无法启动。而在CPP病人中,MKRN3的突变会使其E3连接酶活性减弱,导致GNRH1基因启动子区的去甲基化程度大大增加, GNRH1的转录和HPG轴也被依次激活,青春期发育由此提前启动。
本研究由此揭示了泛素信号、表观遗传调控在下丘脑中交叉对话调控哺乳类动物个体发育中最重要的环节之一——青春期发育调控的新机制;也揭示阐明了人类中枢性性早熟疾病及其相关症状发生发展机理。
分子细胞卓越中心博士后李传银、上海交通大学医学院附属瑞金医院儿内科医生陆文丽及中科院上海营养与健康研究所隶属的中科院-马普学会计算生物学伙伴研究所博士后杨力光为论文的共同第一作者。胡荣贵研究员、高山研究员及李亦学研究员为该论文的共同通讯作者。该项成果受到了国家自然科学基金委、科技部、中科院、上海市科委等的经费支持。该工作的数据收集还得到了分子细胞中心公共技术服务中心动物实验技术平台、分子生物学技术平台和细胞分析技术平台的支持。
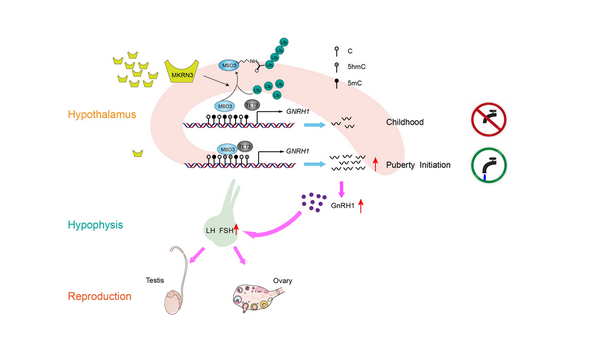
MKRN3-MBD3-TET2调节哺乳动物青春期时间模型
