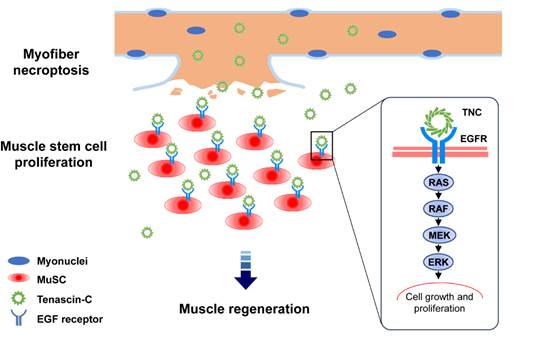
8月24日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)孙丽明研究组和胡苹研究组合作在Cell Research在线发表题为“Myofiber necroptosis promotes muscle stem cell proliferation via releasing Tenascin-C during regeneration”的研究成果。该研究首先发现在肌纤维细胞中阻断细胞坏死的发生会破坏肌肉的修复能力,进一步发现坏死的肌纤维能够释放促肌肉干细胞增殖的因子。利用生物化学纯化结合质谱分析,研究人员发现损伤后的肌纤维细胞瞬时高表达细胞坏死关键蛋白RIPK3和MLKL,发生依赖于p-MLKL的细胞坏死;坏死的肌纤维细胞同时上调Tenascin-C (TNC)蛋白的表达并在MLKL介导的细胞膜破裂后将TNC释放到肌肉干细胞的微环境中。TNC通过其N端的EGFL结构域结合并激活肌肉干细胞的EGFR受体,促进肌肉干细胞的增殖,推动修复。
程序性细胞坏死(necroptosis,以下简称细胞坏死)是一种依赖于RIPK1和RIPK3激酶活性的细胞死亡方式。死亡信号诱导RIPK3激酶的激活,进而磷酸化细胞坏死的特异性执行蛋白MLKL。磷酸化的MLKL(p-MLKL)发生寡聚化并转位到细胞的膜结构上导致细胞膜和细胞器膜的破坏,以致细胞死亡和胞内物质的外漏。
敲除细胞坏死关键蛋白MLKL或者RIPK3的表达并不影响小鼠的发育。传统上普遍认为,过度的细胞坏死会通过释放损伤相关分子模式(damage-associated molecular patterns, DAMP)引起大量炎症反应,介导免疫因子风暴导致的免疫性损伤等有害的病理反应。因此细胞坏死一直被认为扮演着对机体有害的角色。然而,在生理条件下发生的细胞坏死所释放的胞内分子是否含有有益于机体维持稳态的因子的可能一直被忽略。
成体的骨骼肌具有极强的损伤修复能力。肌肉组织在损伤后会迅速启动被肌纤维包裹的肌肉干细胞(muscle stem cells, MuSCs)的激活、增殖和分化,进而形成新的肌纤维细胞在数天之内快速完成修复。因此,肌肉组织是用于研究成体组织损伤后修复的极佳模型。在肌肉损伤修复过程中,肌肉干细胞的激活扩增受到微环境中多种因素的调控。肌纤维的细胞坏死是否参与损伤后修复,以及坏死所释放出来的因子是否构成促肌肉干细胞增殖的微环境都是未知的。
本研究中,为了探究Necroptosis在肌肉损伤修复过程中的功能,研究人员在小鼠中敲除Mlkl 基因使细胞坏死受阻,继而发现Mlkl-/-成体小鼠的骨骼肌在损伤后修复有明显障碍。RIPK3和MLKL蛋白在正常的肌纤维细胞中表达量极低,但在损伤后表达量显著上调;同时MLKL被高度磷酸化,表征着细胞坏死信号通路的激活。而后肌肉干细胞大量增殖,组织修复正式启动。而肌纤维细胞特异性敲除Mlkl基因的MCK-Cre;Mlklf/f 小鼠失去了正常的肌肉损伤修复功能,肌肉干细胞增殖受阻。体外干细胞培养实验发现,诱导发生坏死的肌肉细胞可以释放直接促进肌肉干细胞增殖的因子,且扩增的肌肉干细胞保持着干性。通过生物化学纯化的方法结合质谱分析,研究人员鉴定到一种主要的促增殖因子—— Tenascin-C (TNC),它的N端EGFL结构域能够结合并激活肌肉干细胞表面的表皮生长因子受体(EGFR),从而促进肌肉干细胞的增殖。而后小鼠体内实验验证了TNC在健康的成体肌纤维细胞中几乎不表达,而在损伤后的肌纤维细胞中瞬时高表达,该过程依赖于MLKL诱发的程序性细胞坏死的发生;TNC-EGFR这一轴心对于激活肌肉干细胞扩增扮演着重要角色。综上,在肌肉损伤修复过程中,肌纤维细胞通过发生细胞坏死,在死亡的同时高表达有益于组织修复的TNC,为肌肉干细胞的增殖提供了有利的微环境。这项研究为理解细胞坏死通过释放蛋白因子直接激活组织干细胞增殖,进而推动组织修复,提供了重要的依据。
分子细胞卓越中心孙丽明研究员和胡苹研究员为本文的共同通讯作者,博士研究生周伸奥为本文第一作者。研究过程得到香港中文大学王华婷研究员、北京生命科学研究所陈涉研究员等来自多家单位的专家们的大力协助。该项研究获中科院、国家自然科学基金委、科技部等经费支持,以及分子细胞卓越中心动物实验技术平台、细胞分析技术平台,以及国家蛋白质科学研究(上海)设施等技术支持。