北京时间11月13日凌晨,国际学术期刊Cancer Cell在线发表中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)李林、耶鲁大学吴殿青和国家儿童医学中心、复旦大学附属儿科医院李昊团队的合作研究成果。团队在室管膜瘤临床样品研究中首次发现CXorf67蛋白可以作为儿童颅内PFA型室管膜瘤使用PARP抑制剂的一个重要生物标志物,并发现PARP抑制剂联合放疗是治疗儿童颅内PFA型室管膜瘤的有效手段。
室管膜瘤(Ependymoma)是儿童颅内常见的脑肿瘤,好发于幕下后颅窝,其中以PFA(posterior fossa group A,颅后窝类A)亚型的发病率及恶性程度为最高,主要发生在平均年龄为3岁的儿童中,约40%不可治愈。室管膜瘤目前以手术和放疗为主要的治疗手段,但缺乏有效的化疗药物,尤其是三岁以下的婴幼儿,因无法接受放疗,术后整体预后较差,因此寻找有效的靶向性治疗药物成为了神经外科学界治疗该型肿瘤的一个难题。
团队前期在研究Wnt信号调控DNA损伤修复时,通过磷酸化质谱,鉴定到CXorf67可能参与DNA损伤修复。CXorf67(chromosome X open reading frame 67)基因位于染色体的Xp11.22位置,只有一个外显子,编码503个氨基酸。CXorf67在绝大多数的细胞和组织中都不表达或表达极低,但有报道CXorf67在室管膜瘤的PFA亚型中普遍高表达。2019年有报道CXorf67可参与调节组蛋白甲基化(H3K27me3)水平,但是CXorf67是否参与DNA损伤修复,及其分子机制仍未有研究。
研究人员首先通过生物信息学分析,发现CXorf67高表达的细胞对DNA损伤试剂更加敏感,进一步通过免疫沉淀-质谱分析,发现CXorf67可能结合的蛋白质中含有一系列和DNA损伤修复相关的蛋白质。随后,研究人员确认CXorf67确实可以响应DNA损伤信号,富集到染色质上;并且,通过比较CXorf67野生型和基因敲除型细胞系,发现CXorf67抑制DNA损伤修复过程。随后,利用DNA损伤修复途径的报告基因系统,研究人员发现CXorf67主要通过调控同源重组修复途径来抑制DNA损伤修复过程。进一步的机制研究发现CXorf67通过和BRCA2蛋白竞争结合PALB2蛋白,从而抑制了BRCA2-PALB2复合物参与介导的同源重组修复。
聚腺苷二磷酸核糖聚合酶(Poly (ADP-ribose) polymerase;PARP)是一个蛋白酶,它在DNA修复以及细胞分化与死亡等多种基本的生命活动中扮演重要角色,也是近年来生物学和医药领域备受瞩目的一个肿瘤治疗靶标。PARP抑制剂阻断DNA单链断裂修复时,DNA复制产生双链,如果这时肿瘤细胞的DNA双链同源重组修复存在缺陷,那么细胞就无法进行DNA修复,从而死亡;而正常细胞的DNA同源重组修复没有缺陷,所以不会被杀死,这样PARP抑制剂就能特异性杀死肿瘤细胞。目前,已有靶向PARP的抑制剂被批准用于临床上治疗乳腺癌和卵巢癌等存在同源重组缺陷的肿瘤。CXorf67抑制DNA同源重组修复,所以理论上CXorf67高表达的肿瘤细胞可能会对PARP抑制剂敏感。研究人员为了证实这一点,首先通过比较CXorf67野生型和敲除型细胞,以及在敲除型细胞中回补CXorf67等方法,验证CXorf67的高表达确实明显增强了细胞对PARP抑制剂的敏感性。随后,研究人员建立了室管膜瘤病人原代细胞系和人源肿瘤异种移植模型,结果同样证实CXorf67高表达的肿瘤对PARP抑制剂具有更高的敏感性。而且,CXorf67增强PARP抑制剂对肿瘤的杀伤作用在与放射性治疗联合使用时更为显著。这些研究一致表明CXorf67可以作为一个生物标志物,用于指导PFA型室管膜瘤的靶向PARP的治疗。
分子细胞卓越中心李林研究员、耶鲁大学吴殿青教授和国家儿童医学中心、复旦大学附属儿科医院李昊主任是该文章的共同通讯作者,博士研究生韩记昌、余蒙、柏亦沁和复旦儿童医院余建忠医师为共同第一作者。该研究获分子细胞卓越中心曾嵘研究员、细胞分析技术平台、动物实验技术平台等支持。
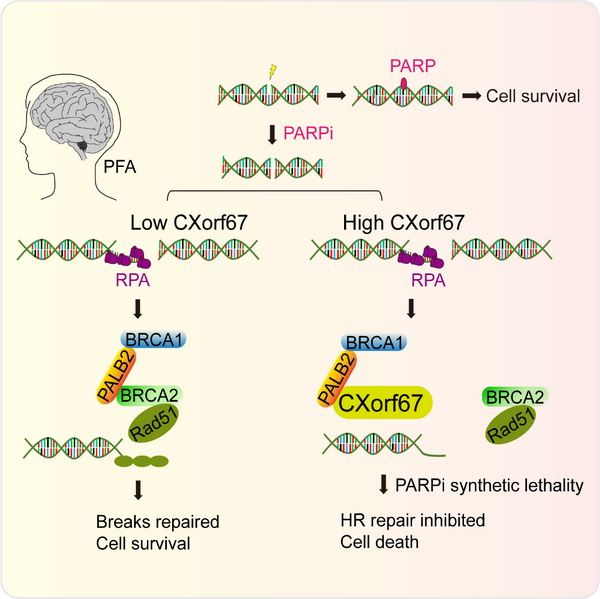
图示: CXorf67作为一个重要的生物标志物,可以用于指导PFA肿瘤的靶向治疗。CXorf67低表达或无表达的PFA型室管膜瘤中,同源重组修复正常进行,肿瘤细胞存活(左); 而CXorf67高表达的PFA型室管膜瘤中,同源重组修复途径被抑制,这时用PARP抑制剂药物处理,肿瘤细胞即被杀死(右)。