11月5日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周斌研究组在国际学术期刊Circulation Research在线发表题为“Sca1+ cells minimally contribute to smooth muscle cells in Atherosclerosis”的研究成果。该研究基于谱系示踪技术,在体内发现Sca1+血管干细胞(VSCs)在动脉粥样硬化的条件下几乎不贡献形成新的血管平滑肌细胞和泡沫细胞,同时也发现在该条件下Sca1+ VSCs标记一群动脉血管内皮细胞,并且在动脉粥样硬化损伤条件下具有显著的增殖能力。
揭示血管干细胞在平滑肌细胞再生中的作用对于了解细胞命运可塑性和寻找新的血管平滑肌再生靶点具有重要的意义。然而,贡献形成血管平滑肌的细胞来源仍然存在争议。值得注意的是,表达Sca1的血管外基质干细胞被认为是动脉粥样硬化形成过程中血管平滑肌形成的的重要来源。最近的一项基于遗传谱系示踪的研究表明,Sca1+ VSCs在严重血管损伤后可以形成新的的平滑肌细胞,显著促进组织修复和再生,但是在体内Sca1+ VSCs是否能在动脉粥样硬化病变中形成新的平滑肌细胞尚不明确。
研究人员将Sca1 CreER;R26-LSL-tdTomato;LDLR-/-(LDLR是低密度脂蛋白基因,敲除后会导致血浆脂质水平升高)三个基因配在一起,经过tamoxifen诱导之后,Sca1 CreER会将R26-LSL-tdTomato中的Loxp-stop-Loxp序列同源重组,tdTomato(红色荧光蛋白)会作为报告基因得以表达,Sca1+细胞会被tdTomato标记。之后对三基因小鼠进行高脂饲料喂养,以诱导动脉粥样硬化血管损伤模型,上述策略可以实现谱系示踪Sca1+ VSCs在动脉粥样硬化中的细胞命运。
实验结果显示,在稳态条件下(没有高脂喂养处理和LDLR未全敲),Sca1 CreER;R26-LSL-tdTomato的谱系示踪系统分别可以部分标记主动脉血管外膜中的成纤维细胞,周细胞,血管内膜中的内皮细胞以及血管周围的脂肪细胞,这与先前研究的结论一致,之后将三基因小鼠进行短期(3个月)和长期(6个月)高脂饲料喂养处理。油红染色结果显示出实验组小鼠成功诱导产生了动脉粥样硬化斑块。冰冻切片和免疫荧光染色结果显示,在动脉粥样硬化诱导3个月和6个月的组织样本中均没有发现tdTomato和αSMA,Calponin,SM22(均为血管平滑肌分子标记)的共定位信号,说明Sca1+ VSCs在动脉粥样硬化过程中不参与形成新的血管平滑肌。考虑到在动脉粥样硬化形成的过程中部分巨噬细胞会由于动脉粥样硬化的炎症效应浸润于斑块,斑块中的巨噬细胞和新形成的平滑肌细胞会特化形成泡沫细胞,流式和免疫荧光染色结果显示Sca1+ VSCs在动脉粥样硬化过程中不参与形成泡沫细胞。与此同时,研究人员发现相比于稳态条件下的小鼠,在发生动脉粥样硬化的小鼠中Sca1标记上的内皮细胞数量水平上升,这说明Sca1+ VSCs可以标记上一群内皮细胞并且在动脉粥样硬化过程中被标记的内皮细胞发生了显著的增殖,提示Sca1+细胞可能是一种内皮干细胞。
该研究工作由博士研究生王海潇,博士后赵欢,博士研究生朱欢等在周斌研究员的指导下完成,项目获得科技部、国家自然科学基金委员会、中科院的经费支持。
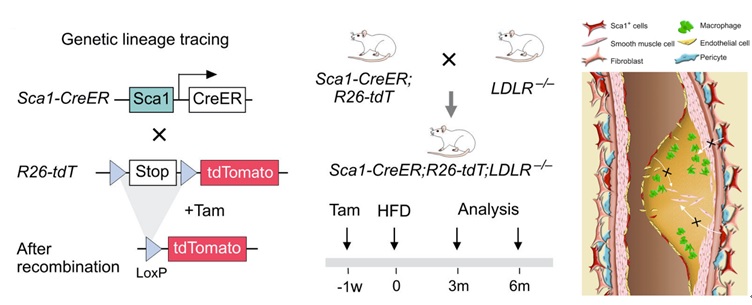
动脉粥样硬化中Sca1+ VSCs谱系示踪策略和分化潜能卡通示意图